
|
下列关于反应热和热化学反应的描述中正确的是 | |
| [ ] | |
A. |
HCl和NaOH反应的中和热ΔH=-57.3 kJ/mol,则H2SO4和Ca(OH)2反应的中和热ΔH=2×(-57.3)kJ/mol |
B. |
CO(g)的燃烧热是283.0 kJ/mol,则2CO2(g) |
C. |
氢气的燃烧热为 285.8 kJ/mol,则水电解的热化学方程式为:2H2O(l)2H2(g)+O2(g) ΔH=+285.8 kJ/mol |
D. |
1 mol CH4燃烧生成气态水和二氧化碳所放出的热量是甲烷的燃烧热 |
|
正确解法:在稀溶液中,强酸跟强碱发生中和反应而生成 1 mol H2O时的反应热叫做中和热,中和热是以生成1 mol H2O为基准的,A选项错误;电解2 mol H2O吸收的热量和2 mol H2完全燃烧生成液态水时放出的热量相等,C选项中的ΔH应为571.6 kJ/mol,C选项错误;在25℃、101 kPa时,1 mol纯物质完全燃烧生成稳定的化合物时(水应为液态)所放出的热量,叫做该物质的燃烧热,D选项错误.点评:学好能量内容的关键之一是要正确理解反应热、燃烧热和中和热的概念,把握三者之间的区别和联系.解答本题时要紧扣概念分析问题,特别要注意正向反应和逆向反应的反应热之间的关系. |


 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案科目:高中化学 来源: 题型:
| 1 |
| 2 |
| 1 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 5 |
| 2 |
| 5 |
| 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
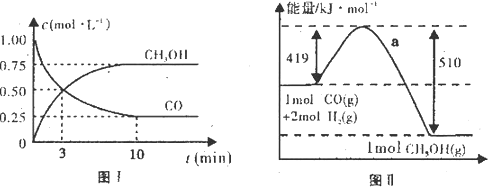
| c(CH3OH) |
| c(CO)c2(H2) |
| c(CH3OH) |
| c(CO)c2(H2) |
| n(CH3OH) |
| n(CO) |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年广东省湛江二中高二(上)期中化学试卷(理科)(解析版) 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com