
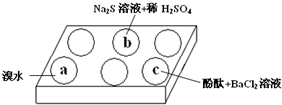
 在白色点滴板上进行Na2SO3 的性质实验探究.如图所示,a、b、c三个凹槽中滴有Na2SO3 溶液,再分别滴加下图所示的试剂:
在白色点滴板上进行Na2SO3 的性质实验探究.如图所示,a、b、c三个凹槽中滴有Na2SO3 溶液,再分别滴加下图所示的试剂:| n(SO3 2-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
分析 (1)Na2SO3 溶液中亚硫酸钠具有还原性和溴单质反应生成硫酸钠;
(2)Na2SO3 溶液与硫化钠、硫酸溶液发生氧化还原反应生成淡黄色硫单质沉淀;
(3)Na2SO3 溶液水解显碱性,使酚酞变红,加入氯化钡会结合亚硫酸根离子形成亚硫酸钡沉淀,水解平衡逆向进行,氢氧根离子浓度减小红色褪去;
(4)①当吸收液中n(SO32-):n(HSO3-)=10:1 时,依据图表分析,溶液呈碱性;
A、依据溶液中电荷守恒分析;
B、溶液中亚硫酸钠多溶液呈碱性,亚硫酸根离子大于亚硫酸氢根离子,钠离子浓度最大;
C、溶液中亚硫酸钠多溶液呈碱性,亚硫酸根离子大于亚硫酸氢根离子,钠离子浓度最大;
②若n(SO32-):n(HSO3-)=3:2,直平写出反应的离子方程式计算.
解答 解:(1)滴入溴水后褪色,说明亚硫酸钠具有还原性,被溴单质氧化为硫酸钠;
故答案为:溴水褪色;还原性;
(2)b中是滴入硫化钠溶液和稀硫酸,硫离子和亚硫酸根离子发生氧化还原反应生成淡黄色沉淀单质硫,发生反应的离子方程式是:SO32-+2S2-+6H+=3S↓+3 H2O;
故答案为:SO32-+2S2-+6H+=3S↓+3 H2O;
(3)d中滴入酚酞溶液变红,再加入BaCl2溶液后产生沉淀且红色褪去,在Na2SO3溶液中,SO32-水解显碱性:SO32-+H2O?HSO3-+OH-,所以滴入酚酞后溶液变红;在该溶液中加入BaCl2后,Ba2++SO32-═BaSO3↓(白色),水解平衡左移,氢氧根离子浓度减小,红色褪去;
故答案为:在Na2SO3溶液中,SO32-水解显碱性:SO32-+H2O?HSO3-+OH-,所以滴入酚酞后溶液变红;在该溶液中加入BaCl2后,Ba2++SO32-═BaSO3↓(白色),由于c(SO32-)减小,SO32-水解平衡左移,c(OH-)减小,红色褪去;
(4)①吸收液中n(SO32-):n(HSO3-)=10:1 时,依据图表数据分析判断,溶液呈碱性,亚硫酸钠物质的量大于亚硫酸氢钠
a、依据溶液中电荷守恒,c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-);故a正确;
b、溶液中亚硫酸钠多溶液呈碱性,亚硫酸根离子大于亚硫酸氢根离子,钠离子浓度最大,离子浓度大小为:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+)
;故b错误;
c、溶液中亚硫酸钠多溶液呈碱性,亚硫酸根离子大于亚硫酸氢根离子,钠离子浓度最大,离子浓度大小为:c(Na+)>c(SO32-)>c(HSO3-)>c(OH-)>c(H+)
;故c正确;
故答案为:ac;
②若n(SO32-):n(HSO3-)=3:2,反应物全部反应,直平得到反应方程式为:5SO2+8NaOH=2NaHSO3+3Na2SO3+3H2O,则0.8mol NaOH溶液吸收了标准状况下的SO2物质的量为0.5mol,标准状况体积为0.5mol×22.4L/mol=11.2L;
故答案为:11.2.
点评 本题考查了物质性质实验验证方法的分析判断,溶液中离子浓度大小比较,溶液中电荷守恒应用,化学方程式的计算分析,盐类水解平衡的影响因素判断,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
| 时间(h) | 开始 | 8 | 16 | 24 | 32 | 40 | 48 |
| pH | 5.0 | 4.8 | 4.5 | 4.3 | 4.2 | 4.0 | 4.0 |
| 编号 | 实验 | 现象 |
| a | 放入蒸馏水 | 木条燃烧 |
| b | 放入Na2SiO3饱和溶液 | 木条不燃烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验①证明KClO3具有还原性 | |
| B. | 实验②中氧化剂与还原剂的物质的量之比为2:1 | |
| C. | 实验③说明KI被氧化 | |
| D. | 上述实验证明氧化性:ClO3->Cl2>I2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 编号 | T/K | 锌规格 | 盐酸浓度/mol•L-1 | 实验目的 |
| ① | 298 | 粗颗粒 | 2.00 | (Ⅰ)实验①和②探究盐酸浓度对该反应速率的影响;(Ⅱ)实验①和 ③探究温度对该反应速率的影响;(Ⅲ)实验①和 ④探究锌规格(粗、细)对该反应速率的影响. |
| ② | 298 | |||
| ③ | 308 | |||
| ④ | 298 |
| 时间(S) | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| 氢气体积(mL) | 16.8 | 39.2 | 67.2 | 224 | 420 | 492.8 | 520.8 | 543.2 | 554.4 | 560 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Ba2+、ClO-、SO42- | B. | Fe3+、H+、SO42-、I- | ||
| C. | Cu2+、NO3-、HCO3-、OH- | D. | K+、Ba2+、NO3-、Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠着火时,立即用沾水的毛巾覆盖 | |
| B. | 配制稀硫酸时将水倒入浓硫酸中并不断搅拌 | |
| C. | 不慎洒出的酒精在桌上着火时,立即用水扑灭 | |
| D. | 大量氯气泄漏时,迅速离开现场并尽量往高处去 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com