
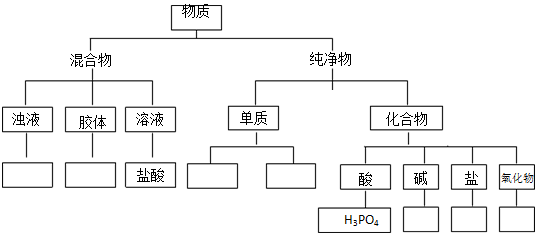
分析 (1)物质依据物质组成分为纯净物和混合物,混合物依据分散质微粒直径大小不同分为溶液、胶体和浊液,纯净物依据组成元素不同分为单质和化合物,单质依据组成元素不同分为金属单质和非金属单质,化合物依据物质组成和性质分为氧化物、酸碱盐.
(2)常温下,(1)中的物质间两两混合,能够制取H2,为Zn和盐酸反应,制取CO2,是利用盐酸和碳酸钙的反应属于复分解反应;
解答 解:(1)①红褐色Fe(OH)3液体为胶体;
②Zn为金属单质;
③Fe2O3为氧化物;
④C为非金属单质;
⑤NaOH为碱;
⑥CaCO3为盐;
⑦泥沙水为浊液.
故答案为: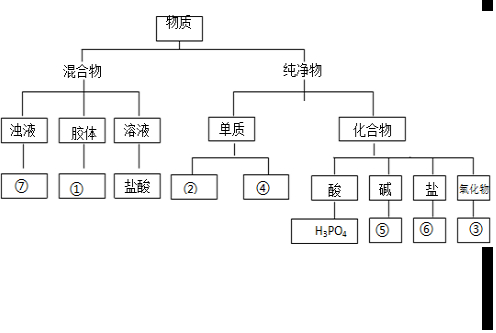 ;
;
(2)常温下,(1)中的物质间两两混合,能够制取H2,为Zn和盐酸反应,Zn+2HCl=ZnCl2+H2↑,属于氧化还原反应、置换反应,制取CO2是利用盐酸和碳酸钙的反应,CaCO3+2HCl=CaCl2+CO2↑+H2O,属于复分解反应,反应过程中无元素化合价变化为非氧化还原反应,故答案为:置换、氧化还原;复分解、非氧化还原.
点评 本题考查了物质组成、物质性质、物质分类等知识点的分析应用,注意积累知识,掌握基础是解题关键,题目难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题
| t/min | X/mol | Y/mol | Z/mol |
| 0 | 1.00 | 2.00 | 0.00 |
| 1 | 0.90 | 1.80 | 0.20 |
| 3 | 0.75 | 1.50 | 0.50 |
| 5 | 0.65 | 1.30 | 0.70 |
| 9 | 0.55 | 1.10 | 0.90 |
| 10 | 0.55 | 1.10 | 0.90 |
| 14 | 0.55 | 1.10 | 0.90 |
 2Z
2Z查看答案和解析>>
科目:高中化学 来源: 题型:选择题
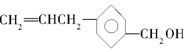 ,下列关于有机物A的说法错误的是( )
,下列关于有机物A的说法错误的是( )| A. | 有机物A可以与氯气反应 | |
| B. | 有机物A与 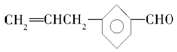 互为同分异构体 互为同分异构体 | |
| C. | 有机物A可与CH3COOH发生酯化反应 | |
| D. | 有机物A可以使酸性KMnO4溶液褪色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 容器 | 甲 | 乙 | 丙 |
| 反应物的投入量 | 1molN2、3molH2 | 2molNH3 | 4molNH3 |
| NH3的浓度(mol•L-1) | c1 | c2 | c3 |
| 反应的能量变化 | 放出akJ | 吸收bkJ | 吸收ckJ |
| 体系的压强(Pa) | p1 | p2 | p3 |
| 反应物的转化率 | a1 | a2 | a3 |
| A. | a+b=92.4 | B. | 2c1>c3 | C. | 2p2<p3 | D. | α1+α3=1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | AgCl在饱和NaCl溶液中的Ksp比在纯水中的Ksp小 | |
| B. | 向AgCl的悬浊液中滴加浓氨水,沉淀溶解,说明AgCl的溶解平衡向右移动 | |
| C. | 将0.001 mol•L-1AgNO3溶液滴入0.001 mol•L-1的KCl和0.001 mol•L-1的K2CrO4溶液中先产生Ag2CrO4沉淀 | |
| D. | 向AgCl的悬浊液中加入NaBr溶液,白色沉淀转化为淡黄色,说明Ksp(AgCl)<Ksp(AgBr) |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
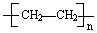 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com