
| A. | Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H=-216 kJ•mol-1,则反应物总能量>生成物总能量 | |
| B. | 相同条件下,如果1 mol氢原子所具有的能量为E1,1 mol氢分子所具有的能量为E2,则2E1=E2 | |
| C. | 101 kPa时,2H2(g)+O2(g)═2H2O(l)△H=-571.6 kJ•mol-1,则H2的燃烧热为571.6 kJ•mol-1 | |
| D. | H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ•mol-1,则含1 mol NaOH的氢氧化钠固体与含0.5 mol H2SO4 的稀硫酸混合后放出57.3 kJ的热量 |
分析 A.反应为放热反应,则反应物总能量>生成物总能量;
B.两个氢原子结合成氢分子时要放出能量;
C.燃烧热是1mol可燃物质完全燃烧生成稳定氧化物放出的热量;
D.氢氧化钠固体溶解要放热;
解答 解:A.Zn(s)+CuSO4(aq)═ZnSO4(aq)+Cu(s)△H=-216 kJ•mol-1,该反应为放热反应,则反应物总能量>生成物总能量,故A正确;
B.两个氢原子结合成氢分子时要放出能量,所以2mol氢原子的能量和要大于1mol氢分子的能量,故B错误;
C.燃烧热是1mol可燃物质完全燃烧生成稳定氧化物放出的热量,所以氢气的燃烧热为285.8kJ•mol-1,故C错误;
D.氢氧化钠固体溶解要放热,所以含1 mol NaOH的氢氧化钠固体与含0.5 mol H2SO4的稀硫酸混合后放出大于57.3 kJ的热量,故D错误;
故选A.
点评 本题考查了放热反应、燃烧热、中和热等概念,理解记忆是解答的关键,题目较简单.


 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案科目:高中化学 来源: 题型:填空题
 50mL 0.50mol•L-1盐酸与50mL 0.50mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和反应反应热.回答下列问题:
50mL 0.50mol•L-1盐酸与50mL 0.50mol•L-1 NaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中放出的热量可计算中和反应反应热.回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 对农作物秸秆进行焚烧还田,以增加土壤肥力 | |
| B. | 推广使用无磷洗衣粉,以减少水体富营养化 | |
| C. | PM2.5是指大气中直径接近于2.5×10-6m(1m=109nm)的颗粒物,也称可吸入颗粒物,这些颗粒物分散在空气中形成的分散系是胶体 | |
| D. | 为提高农作物产量大量使用农药和化肥 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 每断裂1mol H-H键的同时断裂1mol I-I键 | |
| B. | 每断裂1mol I-I键的同时生成2mol H-I键 | |
| C. | 每消耗1molH2的同时消耗2molHI | |
| D. | 压强不发生改变 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 第一电离能:Li<Be<B | B. | 最高正价:O>N>C | ||
| C. | 电负性:O>C>Si | D. | 半径:K+>Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/min | 0 | 15 | 30 | 45 | 60 | 90 | 120 | |
| 滤纸的 颜色 变化 | 玻璃片(Ⅰ) 上的滤纸 | 白色 | 白色 | 灰色 | 浅蓝色 | 蓝色 | 蓝色 | 浅蓝色 |
| 玻璃片(Ⅱ) 上的滤纸 | 白色 | 白色 | 白色 | 白色 | 灰色 | 灰色 | 浅蓝色 | |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氟及其化合物的发现史充满艰辛,现在氟及其化合物在生产生活中被广泛使用,造福人类.
氟及其化合物的发现史充满艰辛,现在氟及其化合物在生产生活中被广泛使用,造福人类.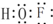
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥ | B. | ②③⑤ | C. | ①④⑤⑥ | D. | ①⑤⑥ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com