
【题目】硼及其化合物在工业上有许多用途。工业上用硼矿石![]() 主要成分为
主要成分为![]() ,还有少量MgO、
,还有少量MgO、![]() 等
等![]() 为原料制备粗硼的工艺流程如图所示。
为原料制备粗硼的工艺流程如图所示。

已知:①偏硼酸钠![]() 易溶于水,在碱性条件下稳定存在。②硼砂的化学式为
易溶于水,在碱性条件下稳定存在。②硼砂的化学式为![]() 。回答下列问题:
。回答下列问题:
(1)欲提高硼矿石的溶解速率,可采取的措施有______![]() 写出两条
写出两条![]() 。
。
(2)滤渣主要成分是______。
(3)硼砂中B的化合价为______,溶于热水后,常用![]() 调pH到2~3制取
调pH到2~3制取![]() ,反应的离子方程式为______。
,反应的离子方程式为______。
(4)![]() 为
为![]() 晶体加热脱水的产物其与Mg反应制取粗硼的化学方程式为______。
晶体加热脱水的产物其与Mg反应制取粗硼的化学方程式为______。
(5)以硼酸为原料可制得硼氢化钠![]() ,它与水反应的离子方程式为
,它与水反应的离子方程式为![]() ,该反应中氧化剂是______;硼氢化钠能把许多金属离子还原为金属单质,为抑制它与水的反应反应可在______
,该反应中氧化剂是______;硼氢化钠能把许多金属离子还原为金属单质,为抑制它与水的反应反应可在______![]() 填“酸性”“中性”或“碱性“
填“酸性”“中性”或“碱性“![]() 条件下进行。
条件下进行。
(6)硼酸熔点为![]() ,露置空气中无变化,加热至
,露置空气中无变化,加热至![]() 时失水而变成偏硼酸
时失水而变成偏硼酸![]() :
:![]() 。已知
。已知![]() 是弱酸,将等体积等物质的量浓度的
是弱酸,将等体积等物质的量浓度的![]() 与NaOH溶液混合,所得溶液中离子浓度从大到小的顺序是______。
与NaOH溶液混合,所得溶液中离子浓度从大到小的顺序是______。
【答案】将硼矿石粉碎、搅拌、增大NaOH溶液的浓度、升温等 MgO、![]()
![]() B4O72+2H++5H2O=4H3BO3
B4O72+2H++5H2O=4H3BO3 ![]()
![]()
![]()
![]() 碱性
碱性 ![]()
【解析】
浓NaOH溶液溶解硼矿石![]() 主要成分为
主要成分为![]() ,还有少量MgO、
,还有少量MgO、![]() 等
等![]() ,MgO、
,MgO、![]() 不溶,
不溶,![]() 溶解生成
溶解生成![]() ,过滤,滤渣为MgO、
,过滤,滤渣为MgO、![]() ,滤液为
,滤液为![]() 溶液,通入适量二氧化碳得到硼砂,将硼砂溶于热水后,用
溶液,通入适量二氧化碳得到硼砂,将硼砂溶于热水后,用![]() 调pH到2~3制取
调pH到2~3制取![]() ,将得到的
,将得到的![]() 晶体加热脱水得到
晶体加热脱水得到![]() ,与Mg高温反应制得硼,据此解答。
,与Mg高温反应制得硼,据此解答。
(1)将硼矿石粉碎、搅拌、增大NaOH溶液的浓度、升温等都可以加快其溶解速率,故答案为:将硼矿石粉碎、搅拌、增大NaOH溶液的浓度、升温等;
(2)![]() 、MgO不溶于NaOH,也不溶于水,故滤渣为MgO、
、MgO不溶于NaOH,也不溶于水,故滤渣为MgO、![]() ,故答案为:MgO、
,故答案为:MgO、![]() ;
;
(3)硼砂![]() 中钠元素
中钠元素![]() 价,氧元素
价,氧元素![]() 价,化合物中元素化合价代数和为0,则B元素化合价为
价,化合物中元素化合价代数和为0,则B元素化合价为![]() 价;硼砂溶于热水后,常用
价;硼砂溶于热水后,常用![]() 调pH到2~3制取
调pH到2~3制取![]() ,反应的离子方程式为:B4O72+2H++5H2O=4H3BO3。故答案为:
,反应的离子方程式为:B4O72+2H++5H2O=4H3BO3。故答案为:![]() ;B4O72+2H++5H2O=4H3BO3;
;B4O72+2H++5H2O=4H3BO3;
(4)![]() 晶体加热脱水的产物X为
晶体加热脱水的产物X为![]() ,与Mg发生置换反应,反应为:
,与Mg发生置换反应,反应为:![]()
![]()
![]() ,故答案为:
,故答案为:![]()
![]()
![]() ;
;
(5)因反应![]() 中,水中氢元素化合价降低,得到电子,则
中,水中氢元素化合价降低,得到电子,则![]() 为氧化剂;因
为氧化剂;因![]() 易与
易与![]() 结合,而碱性溶液可抑制它与水反应,故答案为:
结合,而碱性溶液可抑制它与水反应,故答案为:![]() ;碱性;
;碱性;
(6)将等体积等物质的量浓度的![]() 与NaOH溶液混合,恰好反应完得到
与NaOH溶液混合,恰好反应完得到![]() 溶液,
溶液,![]() 发生水解,
发生水解,![]() 减少,则
减少,则 ,水解反应为:
,水解反应为:![]() ,溶液显碱性,则
,溶液显碱性,则![]() ,水解程度微弱,故
,水解程度微弱,故![]() ,故答案为:
,故答案为:![]() 。
。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】25℃时,H2CO3的Ka1=4.2×10-7,Ka2=5.0×10-11。常温下在20mL0.1mol/LNa2CO3溶液中逐滴加入40mL0.1mol/L'HCl溶液,溶液中含碳元素的各种微粒(CO2因逸出未画出)物质的量分数(纵轴)随溶液pH变化的部分情况如图所示。

下列说法正确的是
A. 在同一溶液中,H2CO3、HCO3-、CO32-能大量共存
B. a点时:c(Na+)+c(H+)=c(OH-)+3c(CO32-)
C. 当pH=7时,溶液中c(Na+)=c(HCO3-)+2c(CO32-)
D. 当溶液中c(HCO3-):c(CO32-)=2:1时,溶液的pH=10
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用0.2000mol·L-1的标准NaOH溶液滴定未知浓度的盐酸,其操作可分为如下几步:
① 用蒸馏水洗涤碱式滴定管后立即注入NaOH溶液至“0”刻度线以上;
② 固定好滴定管并使滴定管尖嘴充满液体;
③ 调节液面至“0”或“0”刻度线稍下,并记下读数;
④ 量取20.00mL待测液注入洁净的锥形瓶中,并加入3滴酚酞溶液;
⑤ 用标准液滴定至终点,记下滴定管液面读数。
请回答:
(1)以上操作步骤中有一步有错误,请指出编号___,该错误操作会导致测定结果___(填“偏大”、“偏小”或“无影响”)。
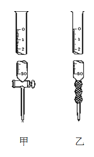
(2)用标准NaOH溶液滴定时,应将标准NaOH溶液注入___中,该仪器的名称是___。(从图中选填“甲”或“乙”)
(3)下列操作会引起实验结果偏大的是:___(填编号)
A.在锥形瓶装液前,留有少量蒸馏水
B.滴定前,碱式滴定管尖嘴有气泡,滴定后无气泡
C.锥形瓶先用蒸馏水洗涤后,再用待测液润洗
D.用酸式滴定管量取待测液时将一滴待测液滴在锥形瓶外
(4)判断达到滴定终点的现象是:___。
(5)以下是实验数据记录表
滴定次数 | 盐酸体积(mL) | NaOH溶液的读数(mL) | |
滴定前 | 滴定后 | ||
1 | 20.00 | 0.00 | 18.28 |
2 | 20.00 | 0.00 | 18.24 |
通过计算可得,该盐酸浓度为:___mol·L-1(计算结果保留2位小数)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】举世闻名的侯氏制碱法的工艺流程如下图所示,下列说法正确的是( )

A.往母液中加入食盐的主要目的是使![]() 更多的析出
更多的析出
B.从母液中经过循环Ⅰ进入沉淀池的主要是![]() 、
、![]() 和氨水
和氨水
C.沉淀池中反应的化学方程式:![]()
D.设计循环Ⅱ的目的是使原料氯化钠的利用率大大提升
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】关于浓度均为0.1 mol/L的三种溶液:①氨水、②盐酸、③氯化铵溶液,下列说法不正确的是
A. c(NH+4):③>①B. 水电离出的c(H+):②>①C. ①和②等体积混合后的溶液:c(H+)=c(OH![]() )+c(NH3·H2O) D. ①和③等体积混合后的溶液:c(NH+4)>c(Cl
)+c(NH3·H2O) D. ①和③等体积混合后的溶液:c(NH+4)>c(Cl![]() )>c(OH
)>c(OH![]() )>c(H+)
)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Bodensteins研究了下列反应:2HI(g)![]() H2(g)+I2(g)
H2(g)+I2(g)![]() 。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用如图表示。当升高温度,再次达到平衡时,v正 v逆可能落在A、B、C、D、E哪些点。

A. A D B. B D C. B E D. A E
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在工农业生产和生命活动中起着重要作用。
(1)氨气是一种重要的化工原料,氨态氮肥是常用的肥料。
哈伯法合成氨技术的相关反应为:N2(g)+3H2(g)![]() 2NH3(g) △H=-93kJ/mol,实际生产中,常用工艺条件:Fe作催化剂,控制温度773K、压强3.0×107Pa,原料气中N2和H2物质的量之比为1:2.8。
2NH3(g) △H=-93kJ/mol,实际生产中,常用工艺条件:Fe作催化剂,控制温度773K、压强3.0×107Pa,原料气中N2和H2物质的量之比为1:2.8。
①合成氨技术是氮的固定的一种,属于______(选填“大气固氮”、“生物固氮”“人工固氮”)。
②合成氨反应常用铁触媒催化剂,下列关于催化剂的说法不正确的是_________。
A.可以加快反应速率 B.可以改变反应热
C.可以减少反应中的能耗 D.可以增加活化分子的数目
③关于合成氨工艺的下列理解,正确的是_________。
A.原料气中N2过量,是因N2相对易得,适度过量有利于提高H2的转化率
B.控制温度(773K)远高于室温,是为了保证尽可能高的平衡转化率和快的反应速率
C.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
D.分离空气可得N2,通过天然气和水蒸气转化可得H2,原料气须经过净化处理,以防止催化剂中毒和安全事故发生
(2)肼(N2H4)是氮的氢化物之一,其制备方法可用次氯酸钠氧化过量的氨气。
①次氯酸钠溶液显碱性,表示原理的离子方程式是_________________________。
②常温下,该水解反应的平衡常数为K=1.0×10-6mol/L,则1.0mol/LNaClO溶液的pH=____。
③肼与N2O4氧化反应生成N2和水蒸气。
已知:N2(g)+2O2(g)=N2O4(l) △H=-19.5kJ/mol
N2H4(l)+O2(g)=N2(g)+2H2O(g) △H=-534.2kJ/mol
请写出肼和N2O4反应的热化学反应方程式_________________________________。
(3)在NH4HCO3溶液中,反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=_____。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7)。
NH3·H2O+H2CO3的平衡常数K=_____。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合下图的是( )
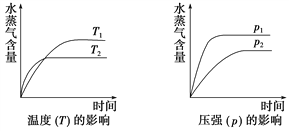
A. CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH>0
CO(g)+H2O(g) ΔH>0
B. CH3CH2OH(g )![]() CH2===CH2(g)+H2O(g) ΔH>0
CH2===CH2(g)+H2O(g) ΔH>0
C. 2C6H5CH2CH3(g)+O2(g) ![]() 2C6H5CH===CH2(g)+2H2O(g) ΔH<0
2C6H5CH===CH2(g)+2H2O(g) ΔH<0
D. CO2(g)+2NH3(g) ![]() CO(NH2)2(s)+H2O(g) ΔH<0
CO(NH2)2(s)+H2O(g) ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若有机分子中的两个碳碳双键仅间隔一个碳碳单键,将这两个碳碳双键称为共轭双键。将含有共轭双键的二烯烃称为共轭二烯烃。最简单的共轭二烯烃为1,3-丁二烯。天然橡胶的单体2-甲基-1,3-丁二烯也是共轭二烯烃。现有一种共轭二烯烃A。A与足量H2充分反应后得到烃B。B的结构简式如图所示。不考虑顺反异构体的情况下,A的可能结构有( )

A.1种B.2种C.3种D.4种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com