
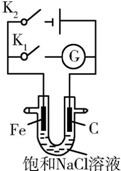
| A. | K1闭合,铁棒上发生的反应为2H++2e-═H2↑ | |
| B. | K1闭合,石墨棒周围溶液的pH逐渐降低 | |
| C. | K2闭合,铁棒不会被腐蚀,属于牺牲阳极的阴极保护法 | |
| D. | K2闭合,电路中通过0.002NA个电子时,两极共产生0.002 mol气体 |
分析 A.K1闭合,该装置是原电池,中性条件下,铁发生吸氧腐蚀,Fe易失电子生成亚铁离子而作负极;
B.K1闭合,该装置是原电池,中性条件下,Fe发生吸氧腐蚀,Fe作负极、C作正极,正极上氧气得电子和水反应生成OH-;
C.K2闭合,该装置是电解池,C作阳极、Fe作阴极,Fe被保护,属于外加电源的阴极保护法;
D.K2闭合,该装置是电解池,C作阳极、Fe作阴极,Fe被保护,阳极上Cl-放电生成氯气、阴极上水得电子生成氢气和OH-,根据电极反应式计算生成气体物质的量.
解答 解:A.K1闭合,该装置是原电池,中性条件下,铁发生吸氧腐蚀,Fe易失电子生成亚铁离子而作负极,负极反应式为Fe-2e-=Fe2+、正极反应式为O2+4e-+2H2O=4OH-,故A错误;
B.K1闭合,该装置是原电池,中性条件下,Fe发生吸氧腐蚀,Fe作负极、C作正极,正极反应式为O2+4e-+2H2O=4 OH-,正极附近有OH-生成导致溶液pH增大,故B错误;
C.K2闭合,该装置是电解池,C作阳极、Fe作阴极,Fe被保护,因为有外加电源,所以属于外加电源的阴极保护法,故C错误;
D.K2闭合,该装置是电解池,C作阳极、Fe作阴极,Fe被保护,阳极上Cl-放电生成氯气、阴极上水得电子生成氢气和OH-,阳极反应式为2Cl--2e-=Cl2↑、阴极反应式为2H2O+2e-=H2↑+2OH-,根据电极反应式知,电路中通过0.002NA个电子即0.002mol电子,阳极上生成n(Cl2)=$\frac{0.002mol}{2}×1$=0.001mol,阴极上生成n(H2)=$\frac{0.002mol}{2}×1$=0.001mol,所以两个电极共产生0.002mol气体,故D正确;
故选D.
点评 本题考查原电池和电解池原理,为高频考点,明确原电池和电解池根本根本及各个电极上发生的反应是解本题关键,会正确书写电极反应式,题目难度不大.


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
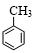 +3HNO3$→_{△}^{浓硫酸}$
+3HNO3$→_{△}^{浓硫酸}$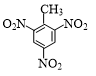 +3H2O.
+3H2O.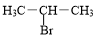 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$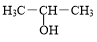 +NaBr.
+NaBr.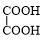 +
+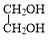 $→_{△}^{催化剂}$
$→_{△}^{催化剂}$ +2H2O.
+2H2O.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 正极有 O2 逸出 | |
| B. | 铜片上有 H2 逸出 | |
| C. | 电子通过导线由铜片流向锌片 | |
| D. | 正极附近的 SO42- 离子浓度逐渐增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.
Na2S2O3是重要的化工原料,易溶于水,在中性或碱性环境中稳定.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | SO2具有还原性,可用于蔗糖脱色 | |
| B. | 双氧水具有强氧化性,可用于杀菌消毒 | |
| C. | 铁粉表面积大,可用作食品干燥剂 | |
| D. | SiO2具有导电性,可用于制造光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属钠着火时使用泡沫灭火器灭火 | |
| B. | 明矾常用于水体的净化、杀菌和消毒 | |
| C. | 热的纯碱溶液去污效果更好 | |
| D. | 84消毒液与洁厕灵混合后用于清洁洗手间的效果更好 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com