
【题目】实验室中有一未知浓度的稀盐酸,某学生用0.10 mol·L-1 NaOH标准溶液进行测定盐酸的浓度的实验。取20.00 mL待测盐酸放入锥形瓶中,并滴加2~3滴酚酞作指示剂,用自己配制的NaOH标准溶液进行滴定。重复上述滴定操作2~3次,记录数据如下。完成下列填空:

实验编号 | 待测盐酸的体积(mL) | NaOH溶液的浓度(mol·L-1) | 滴定完成时,NaOH溶液滴入的体积(mL) |
1 | 20.00 | 0.10 | 24.18 |
2 | 20.00 | 0.10 | 23.06 |
3 | 20.00 | 0.10 | 22.96 |
I、(1)滴定达到终点的标志是是______________________。
(2)根据上述数据,可计算出该盐酸的浓度约为___________(保留小数点后3位)。
(3)排除碱式滴定管尖嘴中气泡的方法应采用________操作,然后轻轻挤压玻璃球使尖嘴部分充满碱液。
(4)在上述实验中,下列操作(其他操作正确)会造成测定结果偏高的有___________。
A.用酸式滴定管取20.00 mL待测盐酸,使用前,水洗后未用待测盐酸润洗
B.锥形瓶水洗后未干燥
C.称量NaOH固体时,有小部分NaOH潮解
D.滴定终点读数时俯视
E.碱式滴定管尖嘴部分有气泡,滴定后消失
II、硼酸(H3BO3)是生产其它硼化物的基本原料。
已知H3BO3的电离常数为5.8×10-10,H2CO3的电离常数为K1=4.4×10-7、K2=4.7×10-11。向盛有饱和硼酸溶液的试管中,滴加0.1 mol/LNa2CO3溶液,____________(填“能”或“不能”)观察到气泡逸出。已知H3BO3与足量NaOH溶液反应的离子方程式为H3BO3+OH-=B(OH)4-,写出硼酸在水溶液中的电离方程式_____________________。
Ⅲ、某温度时测得0.01 mol/L的NaOH溶液pH为11,求该温度下水的离子积常数KW =_________
(1)图I表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL,如果刻度A为4,量简中液体的体积是________mL。

(2)图II表示50mL滴定管中液面的位置,如果液面处的读数是a ,则滴定管中液体的体积(填代号)______________。
A. 是amL
B.是(50-a)mL
C. 一定大于amL
D.一定大于(50-a)mL
【答案】最后一滴NaOH溶液加入,溶液由无色恰好变成浅红色且半分钟内不褪色0.115mol/L丙CE不能H3BO3+H2O![]() B(OH)4-+H+1×10-133.2D
B(OH)4-+H+1×10-133.2D
【解析】
I、(1)酚酞遇盐酸不变色,所以滴有酚酞的盐酸为无色,当达到滴定终点时,滴入最后一滴氢氧化钠则溶液呈碱性,则溶液由无色变为浅红色,且半分钟内不变色;综上所述,本题答案是:最后一滴NaOH溶液加入,溶液由无色恰好变成浅红色且半分钟内不褪色。
(2)根据表中数据,24.18误差太大,不能用,所以消耗氢氧化钠溶液的平均体积是(23.06+22.96)/2=23.01 mL,则盐酸的物质的量浓度是23.01×0.1mol/L/20.00=0.115mol/L;综上所述,本题答案是:0.115mol/L。
(3)排去碱式滴定管中气泡的方法应将尖嘴向上弯起,用手轻轻挤压玻璃球使尖嘴部分充满碱液,所以选择丙;综上所述,本题选丙。
(4)A、酸式滴定管使用前,水洗后未用待测盐酸溶液润洗,则盐酸的物质的量浓度减小,消耗氢氧化钠溶液的体积偏少,结果偏低,错误;
B、锥形瓶水洗后未干燥,对结果无影响,错误;
C、称量NaOH固体时,有小部分NaOH潮解,相当于氢氧化钠溶质的量减小,所配溶液的浓度偏低,滴定后,所用氢氧化钠溶液的体积偏大,结果偏高,正确;
D、滴定终点读数时俯视读数,会导致读数偏小,结果偏低,错误;
E、碱式滴定管尖嘴部分有气泡,导致初读数偏小,滴定后消失,则所用氢氧化钠溶液的体积偏大,结果偏高,正确;
综上所述,本题选CE。
II、H3BO3的电离常数为5.8×10-10, H2CO3的电离常数为K1=4.4×10-7,因5.8×10-10<4.4×10-7,所以不能观察到气泡逸出;已知H3BO3与足量NaOH溶液反应的离子方程式为H3BO3+OH-=B(OH)4-,说明硼酸电离出的离子为四羟基和硼酸根和氢离子,水中电离方程式为: H3BO3+H2O![]() B(OH)4-+H+ ;因此,本题正确答案是:不能;H3BO3+H2O
B(OH)4-+H+ ;因此,本题正确答案是:不能;H3BO3+H2O![]() B(OH)4-+H+ 。
B(OH)4-+H+ 。
Ⅲ、氢氧化钠为强电解质,完全电离,所以0.01 mol/L的NaOH溶液中:c(OH-)=10-2mol/L; 0.01 mol/L的NaOH溶液pH为11,可知c(H+)=10-11mol/L,所以该温度下水的离子积常数KW =c(OH-)×c(H+)=10-2×10-11=10-13;因此,本题正确答案是: 1×10-13。
(1)量筒从下到上刻度值逐渐增大,A与B,B与C刻度间相差1mL,则每刻度为0.2 mL,则如果刻度A为4,则B为3,量简中液体的体积是3.2 mL ;因此,本题正确答案是: 3.2。
(2)滴定管刻度值从上到下刻度逐渐增大,因为滴定管活塞下方或橡皮管无刻度,50mL滴定管中实际盛放液体的体积大于50mL,如果液面处的读数是a,则滴定管中液体的体积大于(50-a)mL;因此,本题正确答案是:D。


科目:高中化学 来源: 题型:
【题目】如图所示甲、乙两个装置,所盛溶液体积和浓度均相同且足量,当两装置电路中通过的电子都是1 mol时,下列说法不正确的是

A. 溶液的质量变化:甲减小,乙增大
B. 溶液pH变化:甲减小,乙增大
C. 相同条件下产生气体的体积:V甲=V乙
D. 电极反应式:甲中阴极:Cu2++2e-==Cu,乙中负极:Mg-2e-==Mg2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸晶体(H2C2O42H2O)无色,易溶于水,熔点为101℃(失水后能升华),170℃以上分解。其钠、钾、铵盐均易溶于水,而钙盐难溶于水。某实验探究小组对草酸晶体进行加热,并验证其分解产物。
(1)加热草酸晶体最适宜选用下图中的_______(填装置编号),不选其它装置的原因是 _________。
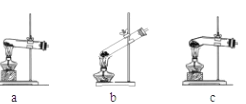
(2)若将产生的气体直接通入澄清石灰水来检验分解产物中是否含CO2,请你评价正确与否并作简要的解释___________。
(3)用下图装置检验草酸的分解产物H2O(g)、CO2和CO.将这种混合气体依次通过___________(填装置中接口的字母,可重复使用)。
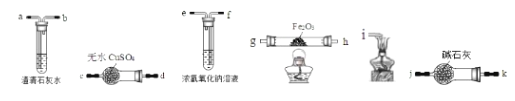
(4)能否依据硬质玻璃管Fe2O3质量的减轻来计算分解产生CO的量?_____。假设硬质玻璃管中所装为铁氧化物的混合物,可能是FeO、Fe2O3、Fe3O4的任意组合,现取ag混合物充分反应后,质量减轻了8a/29克,通过计算确定该混合物中三种氧化物的物质的量的关系为____。
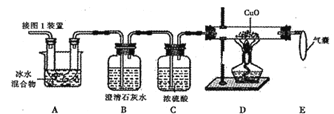
(5)为测定样品中草酸晶体的质量分数,设计如下方案:称取一定量样品,用上述装置进行实验,称量装置D反应前后的质量差。由此计算出的实验结果比实际值偏低,排除仪器和操作因素,其可能原因:_______。
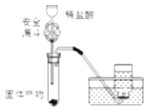
(6)有同学设计下图装置来证明Fe2O3反应后的固体中含有单质铁,你认为可行吗?____,其原因是:_______;图中安全漏斗的作用是____________________。
(7)设计一个简单的实验证明草酸是弱酸:_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知部分弱酸的电离常数如下表:
弱酸 | CH3COOH | HCN | H2CO3 |
电离常数(25 ℃) | Ka=1.8×10-5 | Ka=5.0×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
请回答下列问题:
(1)25 ℃时,在某二元酸 H2A 溶液中存在的所有微粒为:H+、OH-、HA-、A2-、H2O,写出 H2A 的 电离方程式_____。
(2)25 ℃时,在 0.5 mol·L-1 的醋酸溶液中由醋酸电离出的[H+]约是_________,是该溶液 中由水电离出的[H+]的_____倍,醋酸的电离度为_____(填百分数)
(3)写出向氰化钠溶液中通入少量二氧化碳的离子方程式:______________________________。
(4)25 ℃时,CH3COOH 与 CH3COONa 的混合溶液,若测得混合液 pH=6,则溶液中[CH3COO-]-[Na+]=_____(填准确数值)。
(5)25 ℃时,将 a mol·L-1 的醋酸与 b mol·L-1 氢氧化钠溶液等体积混合,反应后溶液恰好显中性, 用 a、b 表示醋酸的电离常数为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有下列两个图象:

下列反应中符合上述图象的是( )
A. N2(g)+3H2(g)![]() 2NH3(g) ΔH<0
2NH3(g) ΔH<0
B. 2SO3(g)![]() 2SO2(g)+O2(g) ΔH>0
2SO2(g)+O2(g) ΔH>0
C. 4NH3(g)+5O2(g)![]() 4NO(g)+6H2O(g) ΔH<0
4NO(g)+6H2O(g) ΔH<0
D. H2(g)+CO(g)![]() C(s)+H2O(g) ΔH>0
C(s)+H2O(g) ΔH>0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第三周期元素X、Y、Z、W的最高价氧化物溶于水可得四种溶液,0.010mol/L的这四种溶液pH与该元素原子半径的关系如下图所示。下列说法正确的是

A. 简单离子半径:X>Y>Z>W
B. Z元素形成的单质存在同素异形体
C. 气态氢化物的稳定性:Z>W>Y
D. X和Y的最高价氧化物对应的水化物恰好中和时,溶液呈中性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将反应Cu(s)+2Ag+(aq)═Cu2+(aq)+2Ag(s)设计成如图所示的原电池,下列叙述正确的是

A. KNO3盐桥中的K+移向CuSO4溶液
B. Ag作负极,Cu作正极
C. 工作一段时间后,CuSO4溶液中c(Cu2+)增大
D. 取出盐桥后,电流计的指针依然发生偏转
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com