
| Al(OH)3 | Fe(OH)2 | Fe(OH)3 | Mn(OH)2 | |
| 开始沉淀时 | 3.4 | 6.3 | 1.5 | 7.6 |
| 完全沉淀时 | 4.7 | 8.3 | 2.8 | 10.2 |
分析 菱锰矿(主要含MnCO3、FeCO3、Al2O3、SiO2),加入过量稀H2SO4,生成硫酸锰、硫酸亚铁、硫酸铝溶液,二氧化硅不溶解,过滤除去二氧化硅;向滤液中加入过量MnO2,将亚铁离子氧化为铁离子,本身被还原为二价锰离子,调节滤液pH,使三价铁离子和铝离子沉淀,过滤除去氢氧化铁和氢氧化铝固体,对硫酸锰溶液进行浓缩、冷切结晶、过滤、洗涤干燥得到产品,
(1)二氧化硅不溶于稀硫酸;
(2)根据化合价升降守恒、电荷守恒、原子守恒配平反应;
(3)注意最后不能引入杂质离子,氯气会引入氯离子;
(4)调节滤液pH,使三价铁离子和铝离子沉淀,而锰离子不能沉淀,根据表格回答;
(5)根据方程式3Mn2++2MnO4-+2H2O=5MnO2+4H+进行计算.
解答 解:菱锰矿(主要含MnCO3、FeCO3、Al2O3、SiO2),加入过量稀H2SO4,生成硫酸锰、硫酸亚铁、硫酸铝溶液,二氧化硅不溶解,;向滤液中加入过量MnO2,将亚铁离子氧化为铁离子,本身被还原为二价锰离子,调节滤液pH,使三价铁离子和铝离子沉淀,过滤除去氢氧化铁和氢氧化铝固体,对硫酸锰溶液进行浓缩、冷切结晶、过滤、洗涤干燥得到产品,
(1)菱锰矿(主要含MnCO3、FeCO3、Al2O3、SiO2),加入过量稀H2SO4,生成硫酸锰、硫酸亚铁、硫酸铝溶液,二氧化硅不溶解,滤渣的主要成分是二氧化硅,
故答案为:二氧化硅;
(2)锰元素化合价由+4价降低到+2价,铁元素由+2价升高到+3价,根据化合价升降守恒、电荷守恒、原子守恒,配平反应为MnO2+2Fe2++4H+=Mn2++2Fe3++2H2O,
故答案为:1、2+4H+、1、2、2H2O;
(3)选用Cl2作为氧化剂会最后的溶液中引入氯离子,使制得的产品不纯,而MnO2不会引入Cl-,使制得的MnSO4?H2O产品更纯净,
故答案为:不会引入Cl-,使制得的MnSO4?H2O产品更纯净;
(4)调节滤液pH,使三价铁离子和铝离子沉淀,根据表格可知二价锰离子开始沉淀的pH=7.6,铝离子开始沉淀的pH=4.7,故4.7≤a<7.6,
故答案为:4.7≤a<7.6;
(5)设含有硫酸锰的物质的量为z,根据方程式
3Mn2++2MnO4-+2H2O=5MnO2+4H+
3mol 2mol
z 0.1y×10-3mol
z=0.15y×10-3mol,
锰元素的质量分数=$\frac{1.5y×1{0}^{-4}×55}{x}$,
故答案为:$\frac{1.5y×1{0}^{-4}×55}{x}$.
点评 本题考查实验制备方案,侧重考查学生对原理及操作的分析评价、对数据的分析运用、物质的分离提纯等,需要学生具备知识的基础,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:推断题
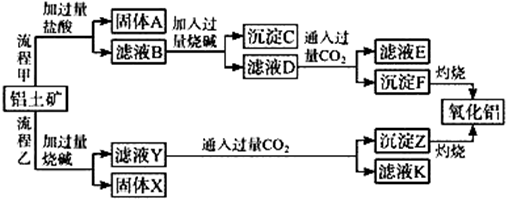
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油的分馏是物理变化,得到的各个馏分都是纯净物 | |
| B. | 乙烯、氯乙烯、聚乙烯均可使酸性高锰钾溶液褪色 | |
| C. | CH3CH218OH和CH3COOH反应生成的水的相对分子质量为18 | |
| D. | 石油裂解可以得到乙烯,煤干馏得到的煤焦油中可以提取苯,乙烯和苯使溴水褪色的原理相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石油的分馏可得到汽油 | |
| B. | 石油分馏得到的重油经过催化裂化可以得到汽油 | |
| C. | 汽油是烃的混合物,煤油、柴油是由烃构成的纯净物 | |
| D. | 石油裂解是为了获得更多化工原料,如乙烯、丙烯等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向溶液中加入盐酸酸化的BaCl2溶液,有白色沉淀生成,说明一定含有SO${\;}_{4}^{2-}$ | |
| B. | 向溶液中滴加盐酸溶液,开始有沉淀生成,继续滴加,沉淀消失,同时有气体逸出,说明一定存在CO32-和AlO${\;}_{2}^{-}$ | |
| C. | 用焰色反应检验时,透过蓝色钴玻璃观察火焰呈紫色,则说明含有K+没有Na+ | |
| D. | 取该粉末,加水后得到无色溶液,且未嗅到气味;用pH试纸测得溶液的pH为12,说明不存在NH${\;}_{4}^{+}$、Al3+、Cu2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
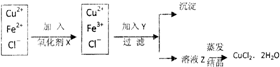
| 物质 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe3+ | 1.9 | 3.2 |
| Fe2+ | 7.0 | 9.0 |
| Cu2+ | 4.7 | 6.7 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com