
| A. | 氢氧化钡溶液与硫酸反应:Ba2++2OH-+SO42-+2H+═BaSO4↓+2H2O | |
| B. | 氧化铜和稀硫酸反应:CuO+2H+═Cu2++H2O | |
| C. | 碳酸氢钠溶液和稀硫酸混合:HCO3-+H+═H2O+CO2↑ | |
| D. | 金属钠与水反应:Na+2H2O═Na++2OH-+H2↑ |
分析 A.氢氧化钡与硫酸反应生成硫酸钡沉淀和水;
B.氧化铜与稀硫酸反应生成硫酸铜和水;
C.碳酸氢钠与稀硫酸反应生成硫酸钠、二氧化碳气体和水;
D.离子方程式两边正电荷不相等,违反了电荷守恒.
解答 解:A.氢氧化钡溶液与硫酸反应生成硫酸钡和水,反应的离子方程式为:Ba2++2OH-+SO42-+2H+═BaSO4↓+2H2O,故A正确;
B.氧化铜和稀硫酸反应的离子方程式为:CuO+2H+═Cu2++H2O,故B正确;
C.碳酸氢钠溶液和稀硫酸混合生成硫酸钠、水和二氧化碳,反应的离子方程式为:HCO3-+H+═H2O+CO2↑,故C正确;
D.钠与水反应生成氢氧化钠和氢气,正确的离子方程式为:2Na+2H2O═2Na++2OH-+H2↑,故D错误;
故选D.
点评 本题考查了离子方程式的判断,为中等难度的试题,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法,如:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等).


 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案 黄冈经典趣味课堂系列答案
黄冈经典趣味课堂系列答案科目:高中化学 来源: 题型:选择题
| A. | vA=0.5mol/(L•s) | B. | vB=0.2mol/(L•s) | C. | vC=0.9mol/(L•s) | D. | vD=1.1mol/(L•s) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
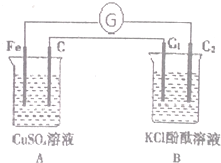 按图装置进行试验时,观察到电流指针发生偏转,B池中C2极区溶液变红,回答下列问题(C,C1,C2均为石墨电极)
按图装置进行试验时,观察到电流指针发生偏转,B池中C2极区溶液变红,回答下列问题(C,C1,C2均为石墨电极)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
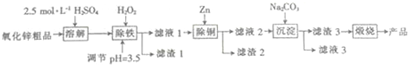
| 离子 | 开始沉淀的pH | 完全沉淀的pH |
| Fe2+ | 6.4 | 8.4 |
| Fe3+ | 2.7 | 3.2 |
| Cu2+ | 5.2 | 6.7 |
| Zn2+ | 6.8 | 9.0 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在28 g聚乙烯树脂中,含有的碳原子数目为2NA | |
| B. | 在合成28 g聚乙烯树脂的单体中,含有的双键数目为NA | |
| C. | 28 g聚乙烯树脂完全燃烧时,转移的电子数目为3NA | |
| D. | 28 g聚乙烯树脂中,含有的C-H键的数目为4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子,G不是稀有气体元素.请回答下列问题:
X、Y、Z、M、G五种元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子,G不是稀有气体元素.请回答下列问题: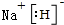 ;ZX与水反应放出气体的化学方程式为2NaH+H2O=2NaOH+H2↑.
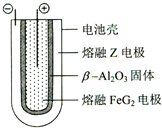
;ZX与水反应放出气体的化学方程式为2NaH+H2O=2NaOH+H2↑. Fe+2ZG,放电时,电池的正极反应式为Fe2++2e-=Fe,该电池的电解质为β-Al2O3.
Fe+2ZG,放电时,电池的正极反应式为Fe2++2e-=Fe,该电池的电解质为β-Al2O3.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H+、Fe2+、NO3-、SO42- | B. | Al3+、NO3-、SO42-、AlO2- | ||
| C. | OH-、HCO3-、Cl-、K+ | D. | Fe3+、K+、SCN-、Cl- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com