
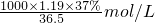 =12.06mol/L,根据稀释前后氯化氢的物质的浓盐酸的体积=
=12.06mol/L,根据稀释前后氯化氢的物质的浓盐酸的体积=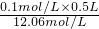 =4.1mL,用10mL量筒量取4.1mL浓盐酸,
=4.1mL,用10mL量筒量取4.1mL浓盐酸, 分析误差,如果n偏小或V偏大则配制溶液浓度偏低.
分析误差,如果n偏小或V偏大则配制溶液浓度偏低. 分析误差,易错点是误差分析,难度不大.
分析误差,易错点是误差分析,难度不大. 

科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
 化学是一门以实验为基础的学科,熟练使用中学化学实验中的常见仪器,熟悉常见实验用品是正确进行实验的基础.试回答以下问题:
化学是一门以实验为基础的学科,熟练使用中学化学实验中的常见仪器,熟悉常见实验用品是正确进行实验的基础.试回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:
 实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况,回答下列问题:
实验室需要0.1mol/L NaOH溶液450mL和0.5mol/L硫酸溶液450mL.根据这两种溶液的配制情况,回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com