
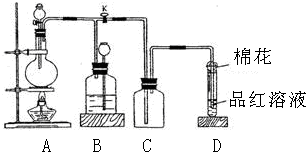
分析 (1)加热条件下,Cu和浓硫酸反应生成硫酸铜、二氧化硫和水;
(2)二氧化硫属于酸性氧化物且有毒,不能直接排空,可以用碱液吸收;
(3)装置B通过长颈漏斗中液面变化贮存二氧化硫;B为气体贮存装置时,盛放的液体不能和二氧化硫反应;
(4)①从浓硫酸随着反应进行浓度变稀,铜不和稀硫酸发生反应分析;
②证明有酸剩余是验证稀硫酸的存在关键是氢离子的检验.
解答 解:(1)加热条件下,Cu和浓硫酸反应生成硫酸铜、二氧化硫和水,反应方程式为2H2SO4(浓)+Cu$\frac{\underline{\;加热\;}}{\;}$CuSO4+2H2O+2SO2↑,
故答案为:2H2SO4(浓)+Cu$\frac{\underline{\;加热\;}}{\;}$CuSO4+2H2O+2SO2↑;
(2)二氧化硫属于酸性氧化物且有毒,不能直接排空,可以用碱液吸收,所以棉花蘸取的溶液可以为NaOH溶液等碱性溶液;其作用是吸收多余的二氧化硫,防止二氧化硫溢出而污染大气,
故答案为:氢氧化钠溶液等碱性溶液;吸收多余的二氧化硫,防止污染空气;
(3)当D处有明显的现象后,关闭旋塞K,移去酒精灯,但由于余热的作用,A处仍有气体产生,导致B中气体压强增大,气压使B中液体通过长颈漏斗液面上升,从而减小压强,防止安全事故发生,此时B中现象是瓶中液面下降,长颈漏斗中液面上升;
B装置的作用是贮存气体,所以B中盛放液体不能和二氧化硫反应,
水、酸性高锰酸钾及NaOH都能和二氧化硫反应,只有亚硫酸氢钠和二氧化硫不反应,故选d;
故答案为:瓶中液面下降,长颈漏斗中液面上升;d;
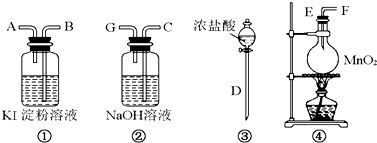
(4)①一定质量的铜片和一定体积18mol•L-1的浓硫酸放在圆底烧瓶中共热,浓硫酸随着反应进行,浓度变小成为稀硫酸,稀硫酸不再和铜发生反应,所以有一定量的余酸但未能使用铜片完全溶解,
故答案为:反应过程中浓硫酸被消耗,逐渐变稀,而铜不和稀硫酸反应;
②能用来证明反应结束后的烧瓶中确有余酸,实质证明氢离子的存在,
a.铁粉与稀硫酸反应放气体,可以证明稀硫酸有剩余,故a正确;
b.BaCl2溶液加入后出现白色沉淀,但因为生成产物中有硫酸铜生成,也可以生成白色沉淀,故不能证明稀硫酸有剩余,故b错误;
c.银粉不与稀硫酸反应,不能证明稀硫酸有剩余,故c错误;
d.NaHCO3溶液会与稀硫酸反应发出二氧化碳气体,可以证明稀硫酸有剩余,故d正确;
故答案为:ad.
点评 本题考查了浓硫酸的性质应用,题目难度中等,涉及反应产物的验证、测定方法的设定和判断,关键是产物中的二氧化硫性质的应用,试题培养了学生的分析能力及化学实验能力.


科目:高中化学 来源: 题型:选择题
| A. | ①④ | B. | ①⑤⑦⑧ | C. | ①⑤⑥ | D. | ⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 属于两性氧化物 | B. | 能与氢氧化钠反应 | ||
| C. | 能与硫酸反应 | D. | 常温下能溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| X | ||
| M |
 ;
; ;
;查看答案和解析>>
科目:高中化学 来源: 题型:解答题
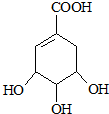
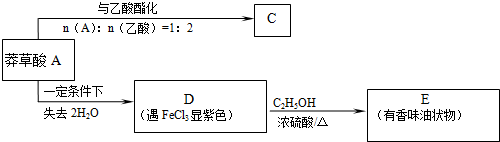
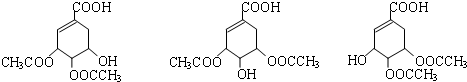 .
.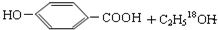 $→_{△}^{浓硫酸}$
$→_{△}^{浓硫酸}$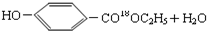 ②E与足量的NaOH溶液反应
②E与足量的NaOH溶液反应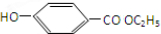 +2NaOH→
+2NaOH→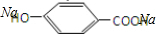 +H2O.
+H2O.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 10.00 | 0.50 | 20.40 |
| 第二次 | 10.00 | 4.00 | 24.10 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | K+、Na+、NO3-、SO42- | B. | Mg2+、K+、NO3-、Cl- | ||
| C. | Na+、Fe2+、NO3-、Cl- | D. | Ba2+、H+、Cl-、SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com