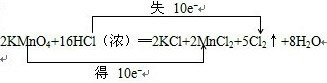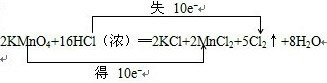对于2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O反应,请回答下列问题:
(1)该反应的氧化剂是______,还原产物是______.
(2)标出该反应的电子转移的方向和数目:______.
(3)若反应时消耗的HCl为73.0g,则转移的电子为______mol,生成Cl2的体积(标准状况)为______L.
【答案】
分析:(1)氧化还原反应中化合价降低元素所在的反应物是氧化剂,对应的产物是还原产物;
(2)氧化还原反应中,化合价降低元素得电子,化合价升高元素失去电子,化合价升高数目=化合价降低数目=转移的电子数目;
(3)氧化还原反应中,化合价降低数目=化合价升高数目=转移的电子数目,根据化学方程式进行计算;
解答:解:(1)氧化还原反应2KMnO
4+16HCl=2KCl+2MnCl
2+5Cl
2↑+8H
2O中,化合价降低的Mn元素所在的反应物KMnO
4是氧化剂,对应的产物MnCl
2是还原产物,故答案为:KMnO
4、MnCl
2;
(2)根据反应2KMnO
4+16HCl(浓)═2KCl+2MnCl
2+5Cl
2↑+8H
2O中元素化合价的变化,可得该反应电子转移的方向和数目如下所示:
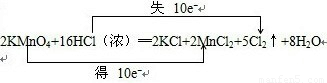
,故答案为:
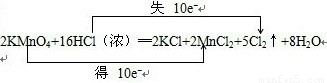
(3)根据(2)可知,当反应消耗的HCl为16mol时,转移的电子为10mol,生成的氯气为5nol,所以当若反应时消耗的HCl为73.0g即2mol时,则转移的电子为1.25mol,生成的氯气为0.625mol,体积为0.625mol×22.4L/mol=14L.
故答案为:1.25,14.
点评:本题考查学生氧化还原反应的有关概念和化学方程式的计算知识,可以根据所学内容来回答,难度不大.

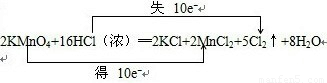 ,故答案为:
,故答案为: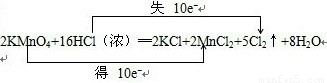


 阅读快车系列答案
阅读快车系列答案