
下列说法正确的是( )
①在一定条件下,糖类、蛋白质、油脂和纤维素都能发生水解反应;②蛋白质、油脂和纤维素都是高分子化合物③石油裂解、煤的气化、海水制镁等过程都包含化学变化;④光导纤维、醋酸纤维、纤维素等的主要成分都是糖类;⑤石油的分馏属于化学变化;⑥利用油脂在碱性条件下的水解,地沟油可以生产甘油和肥皂;⑦蛋白质溶液遇硫酸铜后产生的沉淀能重新溶于水;⑧石油裂化的主要目的是提高汽油等轻质油的产量
A.①③⑤⑧ B.①③⑥⑦⑧ C.③⑥⑧ D.④⑤⑥⑧
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2016-2017学年河南省许昌市五校高二上学期第一次联考化学试卷(解析版) 题型:实验题
某学习小组在实验室制取乙酸乙酯的主要步骤如下:
①配制2mL浓硫酸、3mL乙醇(含18O)和2mL乙酸的混合溶液
②按如图连接好装置并加入混合液,用小火均匀加热3~5min
③待试管乙收集到一定量产物后停止加热,撤出试管乙用力振荡,然后静置待分层
④分离出乙酸乙酯,洗涤、干燥。
回答问题:

(1)装置中球形干燥管,除起冷凝作用外,另一重要作用是 。
(2)步骤(2)安装好实验装置,加入样品前还应检查____________________。
(3)反应中浓硫酸的作用是 ;
写出能表示18O位置的制取乙酸乙酯的化学方程式 。
(4)上述实验中饱和碳酸钠溶液的作用是(填字母) 。
A.中和乙酸并吸收乙醇
B.中和乙酸和乙醇
C.减少乙酸乙酯的溶解
D.加速酯的生成,提高其产率
(5)步骤③所观察到的现象是 ;从试管乙中分离出乙酸乙酯的实验操作名称是 __________________。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上学期9月调研化学试卷(解析版) 题型:选择题
在周期表主族元素中,X元素位于第二周期,且分别与元素Y、Z、W相邻,X、Y的原子序数之和等于Z的原子序数;这四种元素原子的最外层电子数之和为20。下列判断正确的是( )
A. 原子序数:Z>Y>X>W
B. X、Y、Z、W形成的单质最多有6种
C. X元素最高价氧化物对应水化物的化学式为H3XO4
D. 四种元素的气态氢化物中,W的气态氢化物最稳定
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省高二上期初考试化学卷(解析版) 题型:选择题
用惰性电极电解100ml4mol/L的Cu(NO3)2溶液,一段时间后在阳极收集到标况下气体1.12L,停止电解,向电解后的溶液中加入足量的铁粉,充分作用后溶液中Fe2+浓度为(设溶液体积不变)
A.0.75mol/L B.2.75mol/L C.4mol/L D.3.75mol/L
查看答案和解析>>
科目:高中化学 来源:2016-2017学年辽宁省高二上期初考试化学卷(解析版) 题型:选择题
某体积可变的密闭容器,盛有适量的A和B的混合气体,在一定条件下发生反应:A+3B 2C。若维持温度和压强不变,当达到平衡时容器的体积为VL,其中C气体的体积占10%。下列推断正确的是 ( )
2C。若维持温度和压强不变,当达到平衡时容器的体积为VL,其中C气体的体积占10%。下列推断正确的是 ( )
①原混合气体的体积为1.2V L
②原混合气体的体积为1.1V L
③反应达到平衡时气体A消耗掉0.05VL
④反应达平衡时气体B消耗掉0.05V L
A.①③ B.②③ C.①④ D.②④
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高二上开学测化学卷(解析版) 题型:填空题
甲醇被称为2l世纪的新型燃料,工业上通过下列反应①和②,用CH4和H2O为原料来制备甲醇。
① CH4(g)+H2O(g)  CO(g)+3H2(g) ΔH1
CO(g)+3H2(g) ΔH1
② CO(g)+2 H2(g)
H2(g)  CH3OH(g) ΔH2
CH3OH(g) ΔH2
将0.20mol CH4(g)和0.30 mol H2O(g)通入容积为10L的密闭容器中,在一定条件下发生反应①,达到平衡时,CH4的转化率与温度、压强的关系如图。
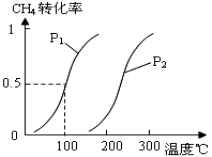
(1)温度不变,缩小体积,增大压强,①的反应速率 ______(填“增大”、“减小”或“不变”),平衡向 ___方向移动。
(2)温度升高,反应①的ΔH1 0(填“<”、“=”或“>”),其平衡常数表达式为K= ,100℃时的平衡常数值是 ______。
(3)在压强为0.1 MPa条件下, 将a mol CO与 3 a mol H2的混合气体在催化剂作用下进行反应②生成甲醇。为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中。请在下表空格中填入剩余的实验条件数据。
实验编号 | T(℃) | n (CO)/n(H2) | P(MPa) |
I | 150 | 1/3 | 0.1 |
II | 5 | ||
III | 350 | 5 |
查看答案和解析>>
科目:高中化学 来源:2016-2017学年黑龙江省高二上开学测化学卷(解析版) 题型:选择题
下列说法中有明显错误的是( )
A.对有气体参加的化学反应,增大压强(体系体积减小),可使单位体积内活化分 子数增加,因而反应速率增大
子数增加,因而反应速率增大
B.升高温度,一般可使活化分子的百分数增大,因而反应速率增大
C.活化分子之间发生的碰撞一定为有效碰撞
D.加入适宜的催化剂,可使活化分子的百分数大大增加,从而成千上万倍地增大化学反应的速率
查看答案和解析>>
科目:高中化学 来源:2016-2017学年河北省高二上9.4周考化学卷(解析版) 题型:填空题
臭氧(O3)能与KI溶液反应,生成O2等。在反应后的溶液中滴入酚酞变为红色,若滴入淀粉则变为蓝色。为测定某环境空气中的臭氧含量,将0℃、1.01×105Pa 空气33 .6m3通过KI溶液,使之完全反应,所得溶液用0.0100mol/L的Na2S2O3溶液60.0mL恰好滴定达终点。反应方程式为:2Na2S2O3+I2= Na2S4O6+ 2NaI。
(1)臭氧通入KI溶液中的化学方程式__________;
(2)滴定过程中选择的指示剂是_________,达到滴定终点时的现象为___________;
(3)计算该空气中臭氧的体积分数。
查看答案和解析>>
科目:高中化学 来源:2016-2017学年四川省高二上入学考试化学试卷(解析版) 题型:选择题
下列根据实验操作和现象所得出的结论正确的是
选项 | 实验操作 | 实验现象 | 结论 |
A | 向某钠盐溶液中滴加稀硫酸 | 产生能使石灰水变浑浊的气体 | 该溶液一定含有CO或HCO |
B | KIO3溶液中加入HI溶液,并加入淀粉 | 溶液变蓝色 | KIO3的氧化性比I2强 |
C | 向Na2S溶液中滴加盐酸 | 产生臭鸡蛋气味的气体 | 氯的非金属性比硫的强 |
D | CO还原Fe2O3得到的黑色固体加入盐酸溶解后,再加入KSCN溶液 | 溶液不显红色 | 黑色固体中无Fe3O4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com