
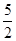 O2(g) == 2CO2(g)+H2O(l) ΔH1=-1301.0 kJ?mol-1
O2(g) == 2CO2(g)+H2O(l) ΔH1=-1301.0 kJ?mol-1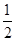 O2(g) == H2O(1) △H3 =" -285.8" kJ·mol-1
O2(g) == H2O(1) △H3 =" -285.8" kJ·mol-1| A.+228.2 kJ·mol-1 | B.-228.2 kJ·mol-1 |
| C.+1301.0 kJ·mol-1 | D.+621.7 kJ·mol-1 |
科目:高中化学 来源:不详 题型:填空题
 CH3OCH3(g) + 3H2O(g) △H < 0
CH3OCH3(g) + 3H2O(g) △H < 0| A.若温度升高,则反应的平衡常数K将增大” |
| B.一定条件下增加H2的浓度可以提高反应速率 |
| C.加入催化剂可提高CO2的转化率 |
| D.恒温恒容条件下若压强保持不变,可认为反应到达平衡状态 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题


| A.有NA的个电子转移时,该反应放出1300KJ的能量 |
| B.有NA个水分子生成且为液体时,吸收1300KJ的能量 |
| C.有2NA个碳氧共用电子对生成时,放出1300KJ的能量 |
| D.有8NA个碳氧共用电子生成时,放出1300KJ的能量 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2NH3的能量变化下图所示,该反应的热化学方程式是 ( )
2NH3的能量变化下图所示,该反应的热化学方程式是 ( )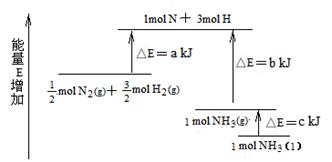
A.N2(g)+3H2(g) 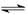 2NH3(1);△H=2(a-b-c)kJ·mol-1 2NH3(1);△H=2(a-b-c)kJ·mol-1 |
B.N2(g)+3H2(g) 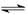 2NH3(g);△H=-2(b-a)kJ·mol-1 2NH3(g);△H=-2(b-a)kJ·mol-1 |
C. N2(g)+ N2(g)+ H2(g) H2(g) 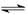 NH3(1);△H=(b+c-a)kJ·mol-1 NH3(1);△H=(b+c-a)kJ·mol-1 |
D. N2(g)+ N2(g)+ H2(g) H2(g) 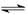 NH3(g);△H=(a+b)kJ·mol-1 NH3(g);△H=(a+b)kJ·mol-1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题

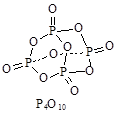
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2H2(g)+O2(g)=2H2O(1)△H= ―285.8kJ/mol |
| B.2H2(g)+ O2(g)=2H2O(1)△H=" +571.6" kJ/mol |
| C.2H2(g)+O2(g)=2H2O(g)△H=" ―571.6" kJ/mol |
D.H2(g)+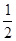 O2(g)=H2O(1)△H = ―285.8kJ/mol O2(g)=H2O(1)△H = ―285.8kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
A.中和热ΔH=-57.3 kJ·mol-1,, 则2H+(aq)+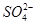 (aq)+Ba2+(aq)+2OH-(aq)===BaSO4(s)+2H2O(l) △H=-114.6 kJ·mol-1 (aq)+Ba2+(aq)+2OH-(aq)===BaSO4(s)+2H2O(l) △H=-114.6 kJ·mol-1 |
| B.将0.5 molN2和1.5 mol H2于密闭容器生成NH3(g),放热19.3 kJ,方程式为: N2(g)+3H2(g)  2NH3(g)△H="—38.6" kJ·mol—1 2NH3(g)△H="—38.6" kJ·mol—1 |
| C.标准状况:H2(g)+F2(g) ==="2HF(g)" △H=-270kJ/mol, |
| D.氨氧化:4NH3(g)+5O2(g) ===4NO(g)+6H2O(g)△H=-1025 kJ/mol |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2(Q1+Q2+Q3) | B.(Q1+Q2+Q3 ) | C.(Q1-Q2+Q3 ) | D.(3Q1-Q2+Q3 ) |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
| A.2H2(g)+O2(g)=2H2O(l)ΔH= -Q1kJ·mol-1; 2H2(g)+O2(g)=2H2O(g)ΔH=-Q2kJ·mol-1 |
| B.S(g)+O2(g)=SO2(g)ΔH = -Q1 kJ·mol-1; S(s)+O2(g)=SO2(g)ΔH=-Q2kJ·mol-1 |
| C.C(s)+1/2O2(g)=CO(g)ΔH = -Q1 kJ·mol-1; C(s)+O2(g)=CO2(g)ΔH=-Q2kJ·mol-1 |
| D.H2(g)+Cl2(g)=2HCl(g)ΔH = -Q1kJ·mol-1; 1/2H2(g)+1/2Cl2(g)="HCl(g)" ΔH= -Q2kJ·mol-1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com