
某同学做元素周期律性质递变规律实验时设计了一套实验方案,并记录了有关实验现象,见下表。请从下表实验现象(Ⅱ)中选出与方案(Ⅰ)对应的实验现象,将其序号(A、B…)填入(Ⅲ)中,并写出相应的化学方程式。
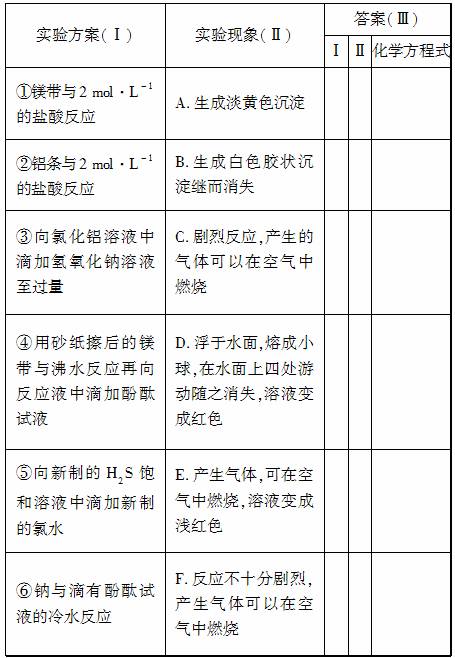
(1)该同学的实验目的是________________________________。
(2)从实验结果可以得出的结论是_______________________。
解析 ⑥(对应D)、④(对应E)做的是Na、Mg分别与水反应的实验,比较两者和水反应的难易程度,及NaOH、Mg(OH)2的碱性强弱;①(对应C)、②(对应F)是比较Mg、Al与盐酸反应的剧烈程度;由③(对应B)可知Al(OH)3是两性氢氧化物;由⑤(对应A)可知Cl2能从H2S溶液置换出S,非金属性Cl>S。
答案
Ⅰ Ⅱ 化学方程式
① C Mg+2HCl===MgCl2+H2↑
② F 2Al+6HCl===2AlCl3+3H2↑
③ B AlCl3+3NaOH===Al(OH)3↓+3NaCl
Al(OH)3+NaOH===NaAlO2+2H2O
④ E Mg+2H2O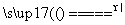 Mg(OH)2+H2↑
Mg(OH)2+H2↑
⑤ A Cl2+H2S===S↓+2HCl
⑥ D 2Na+2H2O===2NaOH+H2↑
(1)验证Na、Mg、Al、S、Cl元素随着核电荷数的递增,金属性逐渐减弱,非金属性逐渐增强的规律
(2)金属性Na>Mg>Al,非金属性S<Cl


科目:高中化学 来源: 题型:
a、b、c三种元素,a、b同周期,a、c同主族,它们原子的最外层电子数之和为16,则这三种元素可能是( )
A.P、S、N B.Cl、S、F
C.S、Cl、O D.K、Ca、Na
查看答案和解析>>
科目:高中化学 来源: 题型:
下列离子方程式书写正确的是
A.铝粉投入到NaOH溶液中:2Al+2OH-══ 2AlO2-+H2↑
B.铁与盐酸反应: Fe + 2H+ ══ Fe3+ + H2 ↑
C.用小苏打治疗胃酸过多: H+ +HCO3-══ H2O + CO2↑
D.Ba(OH)2与稀H2SO4反应: Ba2++OH-+H++SO42-══ BaSO4↓+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
下列能说明氮元素比硫元素非金属性强的是( )
A.NH3比H2S沸点高
B.NH3比H2S热稳定性强
C.HNO3比H2SO3酸性强
D.HNO3比H2SO4挥发性强
查看答案和解析>>
科目:高中化学 来源: 题型:
已知1~18号元素的离子aW3+、bX+、cY2-、dZ-都具有10个电子,下列关系正确的是( )
A.质子数:c>b
B.金属性:X>W
C.氢化物的稳定性:H2Y>HZ
D.原子半径:X<W
查看答案和解析>>
科目:高中化学 来源: 题型:
把锌片和铁片放在盛有稀食盐水和酚酞试液混合溶液的玻璃皿中(如平面图所示),经过一段时间后,首先观察到溶液变红的区域是( )
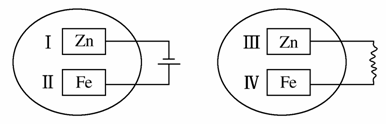
A.Ⅰ和Ⅲ附近 B.Ⅰ和Ⅳ附近
C.Ⅱ和Ⅲ附近 D.Ⅱ和Ⅳ附近
查看答案和解析>>
科目:高中化学 来源: 题型:
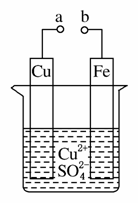
某小组为研究电化学原理,设计如图装置。下列叙述不正确的是( )
A.a和b不连接时,铁片上会有金属铜析出
B.a和b用导线连接时,铜片上发生的反应为Cu2++2e-===Cu
C.无论a和b是否连接,铁片均会溶解,溶液从蓝色逐渐变成浅绿色
D.a和b分别连接直流电源正、负极,电压足够大时,Cu2+向铜电极移动
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述正确的是( )
A.盐酸中滴加氨水至中性,溶液中溶质为氯化铵
B.稀醋酸加水稀释,醋酸电离程度增大,溶液的pH减小
C.饱和石灰水中加入少量CaO,恢复至室温后溶液的pH不变
D.沸水中滴加适量饱和FeCl3溶液,形成带电的胶体,导电能力增强
查看答案和解析>>
科目:高中化学 来源: 题型:
可以由下列反应合成三聚氰胺:CaO+3C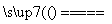 CaC2+CO↑,
CaC2+CO↑,
CaC2+N2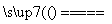 CaCN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,
CaCN2+C,CaCN2+2H2O===NH2CN+Ca(OH)2,
NH2CN与水反应生成尿素[CO(NH2)2],尿素合成三聚氰胺。
(1)写出与Ca在同一周期且最外层电子数相同、内层排满电子的基态原子的电子排布式:_____ ;CaCN2中阴离子为CN ,与CN
,与CN 互为等电子体的
互为等电子体的
分子有N2O和________(填化学式),由此可以推知CN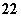 的空间构型为______ __。
的空间构型为______ __。
(2)尿素分子中C原子采取________杂化。
(3)三聚氰胺( )俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸 (
)俗称“蛋白精”。动物摄入三聚氰胺和三聚氰酸 (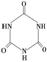 )后,三聚氰酸与三聚氰胺分子相互之间通过________结合,在肾脏内易形成结石。
)后,三聚氰酸与三聚氰胺分子相互之间通过________结合,在肾脏内易形成结石。
(4)CaO晶胞如图所示,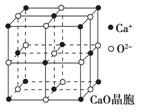 CaO晶体中Ca2+的配位数为 ,
CaO晶体中Ca2+的配位数为 ,
Ca2+采取的堆积方式为 ,
O2-处于Ca2+堆积形成的 空隙中;
CaO晶体和NaCl晶体的晶格能分别为:CaO 3401 kJ·mol-1、NaCl 786 kJ·mol-1。导致两者晶格能差异的主要原因是___________________________________。
(5)配位化合物K3[Fe(CN)n]遇亚铁离子会产生蓝色沉淀,因此可用于检验亚铁离子,已知铁原子的最外层电子数和配体提供电子数之和为14,求n= 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com