
| A. | 硫酸亚铁在空气中被氧化:4Fe2++3O2+6H2O═4Fe(OH)3 | |
| B. | 向CH2Br-COOH中加入足量的NaOH溶液并加热:CH2Br-COOH+OH-$\stackrel{△}{→}$CH2Br-COO-+H2O | |
| C. | FeCl3溶液中通入SO2,溶液黄色褪去:2Fe3++SO2+2H2O═2Fe2++SO42-+4H+ | |
| D. | 碳酸钠溶液滴入酚酞变红:CO32-+2H2O?H2CO3+2OH- |
分析 A.电子、电荷不守恒;
B.-Br发生水解反应;
C.发生氧化还原反应,遵循电子、电荷守恒;
D.碳酸根离子水解分步进行,以第一步为主.
解答 解:A.硫酸亚铁在空气中被氧化的离子反应为4Fe2++2O2+4H+═4Fe3++2H2O,故A错误;
B.向CH2Br-COOH中加入足量的NaOH溶液并加热的离子反应为CH2Br-COOH+2OH-$\stackrel{△}{→}$CH2OH-COO-+Br-+H2O,故B错误;
C.FeCl3溶液中通入SO2,溶液黄色褪去的离子反应为2Fe3++SO2+2H2O═2Fe2++SO42-+4H+,故C正确;
D.碳酸钠溶液滴入酚酞变红的离子反应为CO32-+H2O?HCO3-+OH-,故D错误;
故选C.
点评 本题考查离子反应方程式书写的正误判断,为高频考点,把握发生的反应及离子反应的书写方法为解答的关键,侧重分析与应用能力的考查,注意复分解反应、氧化还原反应中保留化学式的物质及电子、电荷守恒,注重学生思维严密性的训练,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 35Cl原子所含质子数为18 | |
| B. | $\frac{1}{18}$ mol的H35Cl分子所含中子数约为6.02×1023 | |
| C. | 3.5 g的35Cl2气体的体积为2.24 L | |
| D. | 35Cl2气体的摩尔质量为70 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | PM2.5表面积大,能吸附大量的有毒有害物质,对人的肺功能造成很大危害 | |
| C. | 光纤通信使用的光缆主要成分是Si,太阳能电池使用的材料主要是SiO2 | |
| D. | 汽车尾气中含有大量大气污染物,这是汽油不完全燃烧造成的 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 9 g超重水(3H216O)含中子数为6NA | |
| B. | 标准状况下,22.4 L CCl4含有的分子数目为NA | |
| C. | 常温常压下,92g的NO2和N2O4混合气体含有的原子数为6NA | |
| D. | 一定条件下,将1 mol N2和3 mol H2混合,充分反应后转移的电子数为6NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
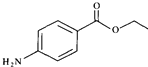
| A. | M分子式为C8H11NO2 | |
| B. | 1 mol M与NaOH溶液反应消耗1 mol NaOH | |
| C. | M与盐酸的反应属于加成反应 | |
| D. | 与M含有相同官能团的同分异构体有8种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1.2 g NaHSO4晶体中阳离子和阴离子的总数为0.03 NA | |
| B. | 25℃时,1L pH=1的硫酸溶液中,含有H+的数目为0.2NA | |
| C. | 2mol SO2与足量氧气在适当的条件下反应生成SO3,转移的电子数为4NA | |
| D. | 含1mol Cl-的NH4Cl溶液中加入适量氨水使溶液呈中性,此时溶液中NH4+数为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
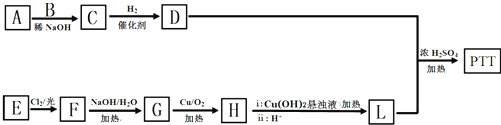
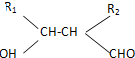
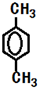 .
.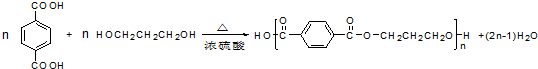 .
.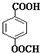 (填结构简式).
(填结构简式).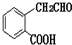 和CH3OH为有机原料制备化合物
和CH3OH为有机原料制备化合物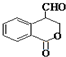 的合成路线流程图(无机试剂任选).(合成路线流程图示例如下CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2$\stackrel{Br_{2}}{→}$
的合成路线流程图(无机试剂任选).(合成路线流程图示例如下CH3CH2OH$→_{170℃}^{浓H_{2}SO_{4}}$CH2=CH2$\stackrel{Br_{2}}{→}$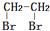 )
)查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:
水是一种重要的自然资源,是人类赖以生存不可缺少的物质.请回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com