
| A. | ①②④⑤ | B. | ②③④⑤ | C. | ①②③④ | D. | ①②③⑤ |
分析 合金相对于组成它的金属来说,一般具有密度较小、熔点较低、耐腐蚀性强、硬度大、机械强度大等方面的特点.
解答 解:①与组成合金的纯金属相比,合金的优点一般硬度更大,故①正确;
②合金的熔点比它的各成分金属的熔点低,故②正确;
③合金的导电性不一定比纯金属更强,比如铝合金的导电性比纯铝要差,故③错误;
④合金一般比成分金属熔点低,硬度大,具有更好的机械加工性能,故应用范围更广泛,故④正确;
⑤不同的合金具有不同的性能,改变原料的配比、改变生成合金的条件,得到有不同性能的合金,故⑤正确;
故选A.
点评 本题考查合金的性质,题目难度不大,注意物质的组成和结构决定物质的性质,物质的性质决定物质的用途.


科目:高中化学 来源: 题型:选择题
| A. | Cu与Cu2O的物质的量之比为2:1 | |
| B. | 沉淀为氢氧化铜 | |
| C. | 产生的NO在标准状况下的体积为4.48 L | |
| D. | Cu、Cu2O与硝酸恰好完全反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 若反应中转移的电子为n mol,则0.15<n<0.25 | |
| B. | n(Na+):n(Cl-) 可能为7:3 | |
| C. | 与NaOH反应的氯气一定为0.15 mol | |
| D. | n(NaCl):n(NaClO):n(NaClO3)可能为11:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 镁铝合金与盐酸反应转移电子数为0.2NA | |
| B. | x=2y | |
| C. | 沉淀为Mg(OH)2和Al(OH)3的混合物 | |
| D. | a的取值范围为0.9<a<1.2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用焰色反应鉴别NaCl、KCl和Na2SO4 | |
| B. | 用氢氧化钠溶液鉴别MgCl2溶液和AlCl3溶液 | |
| C. | 利用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液 | |
| D. | 用加热法鉴别Na2CO3和NaHCO3两种固体 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
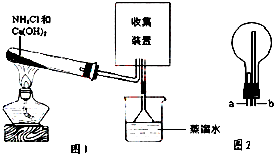 某化学兴趣小组同学用如图所示的实验装置制取氨气并探究氨气的性质,下列有关结论中不正确的是( )
某化学兴趣小组同学用如图所示的实验装置制取氨气并探究氨气的性质,下列有关结论中不正确的是( )| A. | 图1试管中发生反应的化学方程式为:2NH4Cl+Ca(OH)2 $\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2NH3↑+2H2O | |
| B. | 向图1烧杯中滴加酚酞溶液,观察到溶液变红,说明氨水呈碱性 | |
| C. | 用图2装置收集氨气时,进气口是a | |
| D. | 图1中的三角漏斗能起到防止氨气倒吸的作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com