二甲醚(DME)被誉为“21世纪的清洁燃料”.由合成气制备二甲醚的主要原理如下:
①CO(g)+2H
2(g)?CH
3OH(g)△H
1=-90.7kJ?mol
-1②2CH
3OH(g)?CH
3OCH
3(g)+H
2O(g)△H
2=-23.5kJ?mol
-1③CO(g)+H
2O(g)?CO
2(g)+H
2(g)△H
3=-41.2kJ?mol
-1回答下列问题:
(1)则反应3H
2(g)+3CO(g)?CH
3OCH
3(g)+CO
2(g)的△H=
kJ?mol
-1.
(2)下列措施中,能提高CH
3OCH
3产率的有
.
A.使用过量的CO B.升高温度 C.增大压强
(3)反应③能提高CH
3OCH
3的产率,原因是
.
(4)将合成气以
=2通入1L的反应器中,一定条件下发生反应:
4H
2(g)+2CO(g)?CH
3OCH
3(g)+H
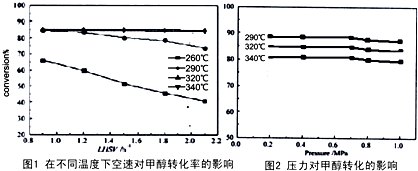
2O(g)△H,其CO的平衡转化率随温度、压强变化关系如图1所示,下列说法正确的是
.
A.△H<0
B.P
1<P
2<P
3C.若在P
3和316℃时,起始时
=3,则达到平衡时,CO转化率小于50%
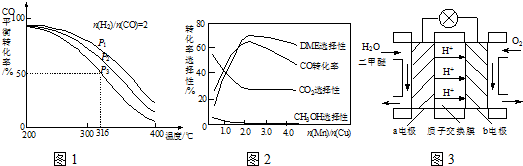
(5)采用一种新型的催化剂(主要成分是Cu-Mn的合金),利用CO和H
2制备二甲醚.观察图2回答问题.催化剂中
约为
时最有利于二甲醚的合成.
(6)图3为绿色电源“二甲醚燃料电池”的工作原理示意图,a电极的电极反应式为
.
(7)甲醇液相脱水法制二甲醚的原理是:CH
3OH+H
2SO
4→CH
3HSO
4+H
2O,CH
3HSO
4+CH
3OH→CH
3OCH
3+H
2SO
4.与合成气制备二甲醚比较,该工艺的优点是反应温度低,转化率高,其缺点是
.




 英才点津系列答案
英才点津系列答案 红果子三级测试卷系列答案
红果子三级测试卷系列答案 课堂练加测系列答案
课堂练加测系列答案