
(8分)有下列八种晶体
| A.金刚石 | B.蔗糖 | C.氧化镁 | D.白磷 E.晶体氩 |
科目:高中化学 来源: 题型:阅读理解
(20分)
(I)多项选择题(6分)
下列说法中正确的是 。
A.丙烯分子中有8个σ键,1个π键
B.在SiO2晶体中,1个Si原子和2个O原子形成2个共价键
C.NF3的沸点比NH3的沸点低得多,是因为NH3分子间有氢键,NF3只有范德华力
D.NCl3和BC13分子中,中心原子都采用sp3杂化
E.在“冰→水→水蒸气→氧气和氢气”的变化过程中,各阶段被破坏的粒子间主要的相互作用依次是氢键、分子间作用力、极性键
(II)(14分)
人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测是钛(Ti),它被誉为“未来世纪的金属”。试回答下列问题:
(1)Ti元素在元素周期表中的位置是第________周期第________族;其基态原子的电子排布式为________。
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定。偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如图所示,它的化学式是 ,其中Ti4+的氧配位数为 ,Ba2+的氧配位数为 ,
(3)常温下的TiCl4是有刺激性臭味的无色透明液体,熔点-23.2℃,沸点136.2℃,所以TiCl4应是 化合物,其固体是 晶体。TiCl4在潮湿空气中易挥发,水解而冒白烟,这是因为水解后有 生成。
(4)已知Ti3+可形成配位数为6的配合物,其空间构型为正八面体,如下图1所示,我们通常可以用下图2所示的方法来表示其空间构型(其中A表示配体,M表示中心原子)。配位化合物[Co(NH3)4Cl2]的空间构型也为八面体型,它有 种同分异构体,请在下图方框中将其画出。
查看答案和解析>>
科目:高中化学 来源:2012届河北省衡水中学高三上学期四调考试化学试卷 题型:填空题
(I)多项选择题
下列说法中正确的是 。
A.丙烯分子中有8个σ键,1个π键
B.在SiO2晶体中,1个Si原子和2个O原子形成2个共价键
C.NF3的沸点比NH3的沸点低得多,是因为NH3分子间有氢键,NF3只有范德华力
D.NCl3和BC13分子中,中心原子都采用sp3杂化
E.SO3与CO32-互为等电子体,SO3是极性分子
(II)人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测是钛(Ti),它被誉为“未来世纪的金属”。试回答下列问题:
(1)Ti元素在元素周期表中的位置是第________周期第________族;其基态原子的电子排布式为________。
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定。偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如右图所示,它的化学式是 ,其中Ti4+的氧配位数为 ,Ba2+的氧配位数为 ,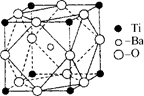
(3)常温下的TiCl4是有刺激性臭味的无色透明液体,熔点-23.2℃,沸点136.2℃,所以TiCl4是 晶体。
4)已知Ti3+可形成配位数为6的配合物,其空间构型为正八面体,如下图1所示,我们通常可以用下图2所示的方法来表示其空间构型(其中A表示配体,M表示中心原子)。配位化合物[Co(NH3)4Cl2]的空间构型也为八面体型,它有 种同分异构体。
(Ⅲ)
(1)已知过氧化氢分子的空间结构如右图所示,分子中氧原子采取 杂化。
(2)R是1~36
号元素中未成对电子数最多的原子。R3+在溶液中存在如下转化关系: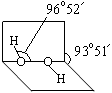
R3+ 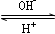 R(OH)3
R(OH)3 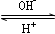 [R(OH)4]-
[R(OH)4]-
①基态R原子的价电子排布式为 ;
②[R(OH)4]-中存在的化学键是 。
A.离子键 B.极性键 C.非极性键 D.配位键
查看答案和解析>>
科目:高中化学 来源:2011届海南省海口市高三下学期高考调研测试(二)化学试卷 题型:填空题
(20分)
(I)多项选择题(6分)
下列说法中正确的是 。
| A.丙烯分子中有8个σ键,1个π键 |
| B.在SiO2晶体中,1个Si原子和2个O原子形成2个共价键 |
| C.NF3的沸点比NH3的沸点低得多,是因为NH3分子间有氢键,NF3只有范德华力 |
| D.NCl3和BC13分子中,中心原子都采用sp3杂化 |


 色透明液体,熔点-23.2℃,沸点136.2℃,所以TiCl4应是 化合物,其固体是 晶体。TiCl4在潮湿空气中易挥发,水解而冒白烟,这是因为水解后有 生成。
色透明液体,熔点-23.2℃,沸点136.2℃,所以TiCl4应是 化合物,其固体是 晶体。TiCl4在潮湿空气中易挥发,水解而冒白烟,这是因为水解后有 生成。
查看答案和解析>>
科目:高中化学 来源:2011-2012学年四川省德阳市高三第一次诊断性考试化学试卷 题型:填空题
(12分)A、B、C、D、E五种均为短周期元素,原子序数依次增大。A元素原子最外层电子数是核外电子层数的3倍,A与D同主族,A和D可形成化合物X’X可以使溴水褪色。A元素的单质和C元素的单质化合可生成Y, Y晶体中无分子,也无A、C的离子。A、B元素的单质一定条件下反应生成化合物M,D、B元素的单质反应生成化合物N,化合物M和化合物N的相对分子质量相等,且馅色反应均呈黄色。
请回答下列问题:
(1) 元素C的气态氢化物是________分子(填写“极性”或“非极性”)。
(2) B2D2的电子式是________________
(3) X可以使溴水褪色,该反应的离子方程式是________________________。
(4) 化合物M与化合物N的水溶液反应,若氧化剂与还原剂物质的量之比为1: 1,该反应的离子方程式是________
(5) 右图是BE晶体的一个“晶胞结构”示意图。下列说法正确的是________________。

A. 与B+距离相等且最近的E_共有6个
B. —个BE晶胞中含有1个B +和1个E_
C. 与B+距离相等且最近的B +有8个
D. 与B+距离相等且最近的构成的空间结构是正八面体
(6) 将原子序数介于B、C两元素之间的单质、单质B与水反应所得的溶液构成原电池,负极的电极反应式是:O
查看答案和解析>>
科目:高中化学 来源:2010-2011学年海南省海口市高三下学期高考调研测试(二)化学试卷 题型:填空题
(20分)
(I)多项选择题(6分)
下列说法中正确的是 。
A.丙烯分子中有8个σ键,1个π键
B.在SiO2晶体中,1个Si原子和2个O原子形成2个共价键
C.NF3的沸点比NH3的沸点低得多,是因为NH3分子间有氢键,NF3只有范德华力
D.NCl3和BC13分子中,中心原子都采用sp3杂化
E.在“冰→水→水蒸气→氧气和氢气”的变化过程中,各阶段被破坏的粒子间主要的相互作用依次是氢键、分子间作用力、极性键
(II)(14分)
人类在使用金属的历史进程中,经历了铜、铁、铝之后,第四种将被广泛应用的金属被科学家预测是钛(Ti),它被誉为“未来世纪的金属”。试回答下列问题:
(1)Ti元素在元素周期表中的位置是第________周期第________族;其基态原子的电子排布式为________。
(2)在Ti的化合物中,可以呈现+2、+3、+4三种化合价,其中以+4价的Ti最为稳定。偏钛酸钡的热稳定性好,介电常数高,在小型变压器、话筒和扩音器中都有应用.偏钛酸钡晶体中晶胞的结构示意图如图所示,它的化学式是 ,其中Ti4+的氧配位数为 ,Ba2+的氧配位数为 ,

(3)常温下的TiCl4是有刺激性臭味的无色透明液体,熔点-23.2℃,沸点136.2℃,所以TiCl4应是 化合物,其固体是 晶体。TiCl4在潮湿空气中易挥发,水解而冒白烟,这是因为水解后有 生成。
(4)已知Ti3+可形成配位数为6的配合物,其空间构型为正八面体,如下图1所示,我们通常可以用下图2所示的方法来表示其空间构型(其中A表示配体,M表示中心原子)。配位化合物[Co(NH3)4Cl2]的空间构型也为八面体型,它有 种同分异构体,请在下图方框中将其画出。

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com