
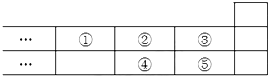
| A. | 元素①位于第二周期第IVA族 | |
| B. | 元素的最高正价是③=⑤ | |
| C. | 最高价氧化物对应水化物的酸性:③>⑤>④ | |
| D. | 气态氢化物的稳定性:④<②<③ |
分析 根据元素周期表中元素的位置确定元素种类;同主族元素,从上到下非金属性逐渐减弱,对应氢化物的稳定性减弱;同周期,从左到右,非金属性逐渐增强,最高价氧化物对应水化物的酸性逐渐增强;氟没有最高正化合价等知识点来解题.
解答 解:①为氮,②为氧,③为氟,④为硫,⑤为氯;
A.①为氮,位于第二周期第VA族,故A错误;
B.③为氟,⑤为氯,氟没有最高正化合价,故B错误;
C.③为氟,④为硫,⑤为氯,硫氯位于同一周期,从左到右非金属性逐渐增强,最高价氧化物对应水化物的酸性增强,最高价氧化物对应水化物酸性:⑤>④,氟无正价,无含氧酸,故C错误;
D.②为氧,③为氟,④为硫,非金属性越强氢化物越稳定,氧硫位于同一主族,从上到下非金属性减弱,气态氢化物稳定性减小,气态氢化物的稳定性:④<②,氟氧位于同周期,非金属性氟大于氧,故氢化物稳定性:④<②<③,故D正确;
故选D.
点评 本题考查位置、结构、性质,熟悉元素周期表中元素的位置确定元素的种类,同主族元素非金属性的递变性,同周期非金属性的递变规律,氟没有最高正化合价等知识点即可解答.


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:解答题
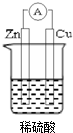 若用锌板和铜板作电极,稀硫酸为电解质溶液,制成一个原电池.试回答:
若用锌板和铜板作电极,稀硫酸为电解质溶液,制成一个原电池.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H与D,16O与18O互为同位素:H216O、D216O、H218O、D218O互为同素异形体 | |
| B. | 元素X含氧酸的酸性强于元素Y的含氧酸的酸性,则X的得电子能力强于元素Y | |
| C. | 质量数相同的不同核素,一定属于不同种元素 | |
| D. | 含有共价键的物质是共价化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 反应物的总键能量低于生成物的总键能 | |
| B. | 该反应是放热反应 | |
| C. | 当A的正反应速率与C的逆反应速率相同时处于平衡状态 | |
| D. | 当A、B、C、D的浓度相同时,反应处于平衡状态 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 构成电池的两极必须是活泼性不同的金属 | |
| B. | 锌锰干电池工作时,锌作负极 | |
| C. | 在电池中,电子流出的一极是负极,发生还原反应 | |
| D. | 铅蓄电池工作时,电子由Pb电极流出经过溶液后流向PbO2电极 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将0.l mol•L-1醋酸溶液加水稀释,溶液中所有离子的浓度都减小 | |
| B. | 0.1 mol/L的一元弱酸HA加水稀释过程中,$\frac{c({A}^{-})}{c(HA)•c(O{H}^{-})}$ 不变 | |
| C. | 中和pH与体积均相同的盐酸和醋酸溶液,消耗NaOH的物质的量相同 | |
| D. | 中和10 mL 0.1mol•L-1醋酸与中和100 mL 0.01mol•L-1的醋酸所需同种碱液的量不同 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
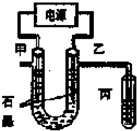 CuCl2溶液中的铜主要以Cu (H2O)42+、CuCl42-形式存在,它们间有如下转化关系:Cu(H2O)42+(蓝色)+4Cl-?CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电.下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝.回答下列问题:
CuCl2溶液中的铜主要以Cu (H2O)42+、CuCl42-形式存在,它们间有如下转化关系:Cu(H2O)42+(蓝色)+4Cl-?CuCl42-(黄色)+4H2O;电解不同浓度的CuCl2溶液,均可看做Cu2+、Cl-直接放电.下图为电解浓度较大CuCl2溶液的装置,实验开始后,观察到丙中的KI-淀粉溶液慢慢变蓝.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com