
| A. | 用氨水溶解氯化银沉淀:Ag++2NH3•H2O=[Ag(NH3)2]++2H2O | |
| B. | Mg(HCO3)2溶液中加入足量NaOH溶液:Mg2++2HCO3-+2OH-═Mg CO3↓+CO32-+2H2O | |
| C. | Na2O2固体投入H218O中:2H218O+2Na2O2=4Na++4OH-+18O2↑ | |
| D. | 苯酚钠溶液跟AlCl3溶液反应:3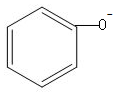 +Al3++3H2O→ +Al3++3H2O→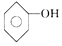 +Al(OH)3↓ +Al(OH)3↓ |
分析 A.银离子与一水合氨反应生成[Ag(NH3)2]+;
B.氢氧化钠足量,氢氧化镁更难溶,反应生成氢氧化镁沉淀;
C.氧气中O元素来自过氧化钠;
D.苯酚钠与硫化铝发生双水解反应生成苯酚和氢氧化铝沉淀.
解答 解:A.银离子与一水合氨反应生成[Ag(NH3)2]+,AgCl不能拆开,正确的离子方程式为AgCl+2NH3•H2O=[Ag(NH3)2]++2H2O+Cl-,故A错误;
B.Mg(HCO3)2溶液中加入足量NaOH溶液,反应生成碳酸钠、氢氧化镁沉淀和水,正确的离子方程式为:Mg2++2HCO3-+4OH-═Mg (OH)2↓+2CO32-+2H2O,故B错误;
C.Na2O2固体投入H218O中,反应生成氢氧化钠和氧气,正确的离子方程式为:2H218O+2Na2O2=4Na++218OH-+2OH-+O2↑,故C错误;
D.苯酚钠与AlCl3发生双水解反应生成苯酚和氢氧化铝沉淀,反应的离子飞方程式为:3 +Al3++3H2O→3
+Al3++3H2O→3 +Al(OH)3↓,故D正确;
+Al(OH)3↓,故D正确;
故选D.
点评 本题考查了离子方程式的书写判断,为高考的高频题,题目难度不大,注意掌握明确离子方程式正误判断常用方法:检查反应能否发生,检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | a气体是氯气,b气体是氢气 | |
| B. | 为使a、b气体恰好完全反应,理论上每生产1molClO2需要补充56L(标准状况)b气体 | |
| C. | ClO2发生器中的还原反应为:2ClO3-+12H++10e-═Cl2↑+6H2O | |
| D. | 氯化钠电解槽内每生成2 mol a气体,转移2mol e- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 操作及现象 | 结论 | |
| A | 其他条件相同,测定等浓度的HCOOK和K2S溶液的PH | 比较Ka(HCOOH)和K${\;}_{{a}_{2}}$(H2S)的大小 |
| B | 向某溶液中滴加氯水后再加入KSCN溶液,溶液呈红色 | 溶液中一定含有Fe2+ |
| C | 向等体积等浓度的H2O2溶液中分别加入5滴等浓度的CuSO4和KMnO4溶液,观察气体产生的速度 | 比较CuSO4和KMnO4的催化效果 |
| D | C2H5OH与浓硫酸混合后加热到170℃,制得的气体使酸性KMnO4溶液褪色 | 一定是制得的乙烯使酸性KMnO4溶液褪色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 四氯化碳分子比例模型: | B. | 二 氧化硅的分子式:SiO2 | ||
| C. | 溴化铵的电子式: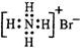 | D. | S2-离子结构示意图: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 化学事实 | 类推结论 |
| A | Al在O2中燃烧生成Al2O3 | Fe在O2中燃烧也生成Fe2O3 |
| B | 用分别蘸取了浓盐酸和浓氨水的两根玻璃棒相互靠近不接触,可看到白烟 | 用分别蘸取了浓硫酸和浓氨水的两根玻璃棒相互靠近不接触,可以看到白烟 |
| C | 电解熔融MgCl2的方法冶炼金属镁 | 电解熔融NaCl的方法制取金属钠 |
| D | 将SO2通入BaCl2溶液中无沉淀生成 | 将SO2通入Ba(NO3)2溶液中也无沉淀生成 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| MnO2 | 触摸试管情况 | 观察结果 | 反应完成所需的时间 |
| 粉末状 | 很烫 | 剧烈反应,带火星的木条复燃 | 3.5min |
| 块状 | 微热 | 反应较慢,火星红亮但木条未复燃 | 30min |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28.4 | B. | 28.4g/mol | C. | 71 | D. | 71g/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com