
| A. | 3 | B. | 17 | C. | 20 | D. | 37 |
科目:高中化学 来源: 题型:选择题
| A. | 只有②④⑥ | B. | 只有①⑤⑥ | C. | 只有②③④ | D. | 只有③⑤⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
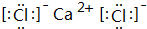 ;
; .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 反应生成2mol氯化氢气体,吸收248KJ的能量 | |
| B. | 反应生成2mol氯化氢气体,放出183KJ的能量 | |
| C. | 反应物的总能量低于生成物的总能量 | |
| D. | 该反应为吸热反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,1.12L CCl4中含有C-Cl键数目为0.2NA | |
| B. | 标准状况下,2.24L氯气中含有${\;}_{17}^{35}$Cl数目一定为0.2NA | |
| C. | 常温常压下,4.4g CO2与N2O混合气体中含有的原子总数为0.3NA | |
| D. | 80 mL 10 mol•L-1 盐酸与足量MnO2加热反应,产生Cl2的体积为4.48L |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 加入硫酸钠固体 | B. | 加入水 | ||
| C. | 加入100mL 1mol/L硫酸 | D. | 把锌粉换成锌粒 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
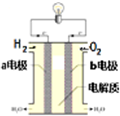 能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率.
能源是现代文明的原动力,通过化学方法可以使能量按人们所期望的形式转化,从而开辟新能源和提高能源的利用率.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
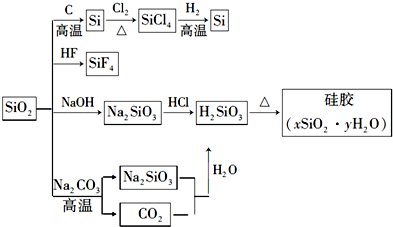
| A. | SiO2属于两性氧化物 | |
| B. | 盛放Na2CO3溶液的试剂瓶不能用玻璃塞 | |
| C. | 硅胶吸水后不能重复再生 | |
| D. | 图中所示转化反应都是氧化还原反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com