
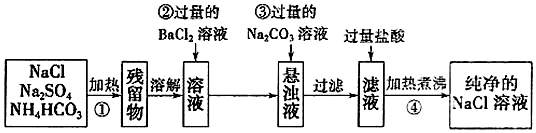
分析 混有硫酸钠、碳酸氢铵的氯化钠固体,由流程可知,①中发生加热条件下分解反应,分解后的固体溶于水后,与氯化钡反应除去硫酸根离子,再利用碳酸钠除去过量的钡离子,过滤后滤液中含NaCl、碳酸钠,加盐酸除去碳酸钠后溶质为NaCl,蒸发得到纯净的NaCl,以此来解答.
解答 解:混有硫酸钠、碳酸氢铵的氯化钠固体,由流程可知,①中发生加热条件下分解反应,分解后的固体溶于水后,与氯化钡反应除去硫酸根离子,再利用碳酸钠除去过量的钡离子,过滤后滤液中含NaCl、碳酸钠,加盐酸除去碳酸钠后溶质为NaCl,蒸发得到纯净的NaCl,
(1)操作①中发生反应为碳酸氢铵受热分解生成氨气、二氧化碳和水,反应的化学方程式为:NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+CO2↑+H2O,
故答案为:NH4HCO3$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+CO2↑+H2O;
(2)操作②反应是加入过量氯化钡溶液沉淀硫酸根离子生成硫酸钡沉淀,不能利用硝酸钡,引入新杂质离子硝酸根离子,
故答案为:不能;选用Ba(NO3)2溶液会引入新的杂质离子NO3-;
(3)操作③的反应是加入过量碳酸钠沉淀过量的钡离子;取出上层清夜少量,加入BaCl2溶液,观察是否有白色沉淀生成,所以操作为:除去过量的Ba2+;待沉淀完全后,静置,取出上层清夜少量,加入BaCl2溶液,若产生白色沉淀,则可确认Na2CO3已过量,
故答案为:除去过量的Ba2+;待沉淀完全后,静置,取出上层清夜少量,加入BaCl2溶液,若产生白色沉淀,则可确认Na2CO3已过量;
(4)由于滤液中含有过量的氯化氢和溶解的二氧化碳气体,通过加热可以驱赶溶解在溶液中的CO2气体和HCl,故答案为:除去溶解在溶液中的CO2气体和HCl.
点评 本题考查混合物分离提纯实验方案的设计,为高频考点,把握流程中的化学反应及混合物分离方法为解答的关键,侧重分析与实验能力、推断能力的考查,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 加入过量NaOH溶液:Na+、AlO2-、OH-、SO42- | |
| B. | 加入过量氨水:NH4+、Al3+、OH-、SO42- | |
| C. | 通入过量Cl2:Fe2+、Na+、Cl-、SO42- | |
| D. | 通入过量SO2:Fe2+、H+、SO32-、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
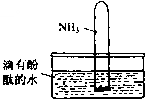 氨气是一种重要的化工原料,氨态氮肥是常用的肥料.
氨气是一种重要的化工原料,氨态氮肥是常用的肥料.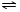 NH3•H2O
NH3•H2O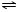 NH4++OH-,NH3易溶于水,试管内压强减小,液面上升;电离出OH-,溶液呈碱性,故溶液变为红色.
NH4++OH-,NH3易溶于水,试管内压强减小,液面上升;电离出OH-,溶液呈碱性,故溶液变为红色.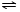 NH3•H2O+H+
NH3•H2O+H+查看答案和解析>>
科目:高中化学 来源: 题型:解答题
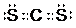 ,该分子为非极性(选填“极性”、“非极性”)分子.
,该分子为非极性(选填“极性”、“非极性”)分子.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2SO4[H2SO4] | B. | KBr[H2O] | C. | 盐酸[HCl] | D. | Cu(NO3)2[Cu(OH)2] |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2Na2O2(s)+2CO2( s)=2Na2CO3(s)+O2(g)△H>-452 kJ/mol | |
| B. | CO的燃烧热为283 kJ | |
| C. | 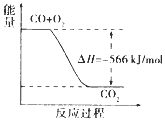 如图可表示由CO生成CO2的反应过程和能量关系 | |
| D. | CO(g)与Na2O2(s)反应放出509kJ热量时,电子转移数为6.02×l023 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A | B | C | D |
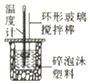 |  |  |  |
| 测中和热 | 向沸水中滴加FeCl3饱和溶液,在加热到出现红褐色沉淀,即制得Fe(OH)3胶体 | 实验室原油蒸馏 | 吸收CO2中的HCl杂质 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温下,10g46%的CH3CH2OH溶液中所含有的氧原子数为0.4NA | |
| B. | 向FeI2溶液中通人适量的Cl2,当有1molFe2+被氧化时,共转移电子数目为3NA | |
| C. | 在标准状况下,将11.2LHCl溶于1L水中,溶液中HCl分子数为0.5NA | |
| D. | 常温常压下,0.1molNaHSO4晶体中,含有阴阳离子数共0.3NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com