
美国LawreceLiremore国家实验室(LLNL)的V.Lota.C.S.Yoo和Cynn成功地在高压下将CO2转化为具有类似SiO2结构的原子晶体,下列关于CO2的原子晶体说法中正确的是( )
A.CO2的原子晶体中存在范德华力,每1 mol CO2原子晶体中含有2NAπ键
B.在一定条件下,CO2原子晶体转化为CO2分子晶体是物理变化
C.熔点:金刚石>原子晶体CO2
D.在CO2的原子晶体中,每个C原子周围结合4个O原子,每个O原子与两个C原子相结合
 金钥匙试卷系列答案
金钥匙试卷系列答案科目:高中化学 来源:2014高考化学名师选择题专练 化学与STSE练习卷(解析版) 题型:选择题
化学在生产和日常生活中有着重要的应用。下列叙述正确的是( )
A.氯气是合成塑料、橡胶、农药和制盐酸、有机溶剂的重要原料
B.“辽宁舰”上用于舰载机降落拦阻索的特种钢缆,属于新型无机非金属材料
C.白酒中混有少量塑化剂,少量饮用对人体无害,可通过过滤方法除去
D.汽车尾气中含有氮的氧化物,是汽油不完全燃烧造成的
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师综合题专练 物质性质综合应用练习卷(解析版) 题型:填空题
某工业废渣的主要成分为SiO2、Fe2O3、Al2O3、MgO。现根据下列方案对其进行处理以回收废渣中的金属元素。
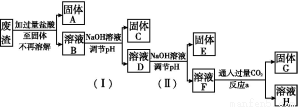
回答下列问题。
(1)固体A的化学式为 。
(2)反应a的化学反应方程式为 。
(3)25 ℃时,溶液中金属离子的物质的量浓度与溶液pH的关系如图所示:
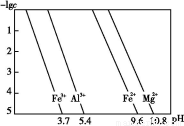
①调节pH(Ⅰ)的pH为 ;
②溶液D加入氢氧化钠溶液的同时调节pH(Ⅱ)所发生反应的离子方程式为 ;
③从图中数据计算可得Mg(OH)2的溶度积Ksp[Mg(OH)2]约为 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师综合题专练 化学实验练习卷(解析版) 题型:实验题
为探究某铁碳合金与浓硫酸在加热条件下的反应的部分产物并测定铁碳合金中铁元素的质量分数,某化学活动小组设计了如图所示的实验装置,并完成以下实验探究。
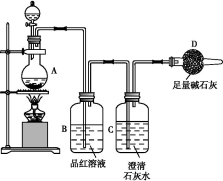
(1)往圆底烧瓶中加入m g铁碳合金,并滴入过量浓硫酸,未点燃酒精灯前,A、B均无明显现象,其原因是:①常温下,Fe在浓硫酸中钝化;② 。
(2)反应一段时间后,从A中逸出气体的速率仍然较快,除因反应温度较高外,还可能的原因是 。
(3)装置B的作用是 。
(4)甲同学观察到装置C中有白色沉淀生成,他得出了使澄清石灰水变浑浊的气体是二氧化碳。装置A中能产生二氧化碳的化学方程式为 。
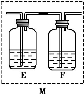
(5)乙同学认为甲同学的结论是错误的,他认为为了确认二氧化碳的存在,需在装置B-C之间添加装置M。装置E、F中盛放的试剂分别是 、 。重新实验后观察到装置F中的现象是 。
(6)有些同学认为合金中铁元素的质量分数可用KMnO4溶液来测定(5Fe2++Mn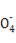 +8H+
+8H+ 5Fe3++Mn2++4H2O)。
5Fe3++Mn2++4H2O)。
测定铁元素质量分数的实验步骤如下:
Ⅰ.往烧瓶A中加入过量的还原剂使溶液中的Fe3+完全转化为Fe2+,过滤,得到滤液B;
Ⅱ.将滤液B稀释为250 mL;
Ⅲ.取稀释液25.00 mL,用浓度为c mol·L-1的酸性KMnO4溶液滴定,三次滴定实验所需KMnO4溶液体积的平均值为V mL。
①步骤Ⅱ中,将滤液B稀释为250 mL需要用到的玻璃仪器除烧杯、玻璃棒、胶头滴管外,还必须要用到的是 。
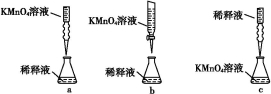
②丙同学设计了下列滴定方式(夹持仪器省略),最合理的是 (填字母序号)。
③滴定过程中 (填“需要”或“不需要”)加入指示剂。
④铁碳合金中铁元素的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师综合题专练 化学反应原理练习卷(解析版) 题型:填空题
恒温恒容条件下,硫可以发生如下转化,其反应过程和能量关系如图1所示。已知:2SO2(g)+O2(g) 2SO3(g)
2SO3(g)
ΔH=-196.6 kJ/mol。
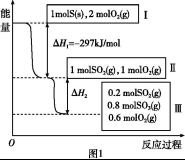
请回答下列问题:
(1)写出能表示硫的燃烧热的热化学方程式: 。
(2)ΔH2= 。
(3)恒温恒容时,1 mol SO2和2 mol O2充分反应,放出热量的数值比∣ΔH2∣ (填“大”、“小”或“相等”)。
(4)将Ⅲ中的混合气体通入足量的NaOH溶液中消耗NaOH的物质的量为 ,若溶液中发生了氧化还原反应,则该过程的离子方程式为 。
(5)恒容条件下,下列措施中能使n(SO3)/ n(SO2)增大的有 。
a.升高温度
b.充入He气
c.再充入1 mol SO2(g)和1 mol O2(g)
d.使用催化剂
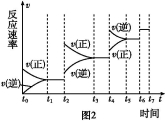
(6)某SO2(g)和O2 (g)体系,时间t1达到平衡后,改变某一外界条件,反应速率v与时间t的关系如图2所示,若不改变SO2(g)和O2 (g)的量,则图中t4时引起平衡移动的条件可能是 ;图中表示平衡混合物中SO3的含量最高的一段时间是 。
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 选修3物质结构与性质练习卷(解析版) 题型:填空题
A、B、C、D、E是周期表中前四周期的元素,其有关性质或结构信息如下表:
元素有关性质或结构信息
A负二价的A元素的氢化物在通常状况下是一种液体,其中A的质量分数为88.9%
BB原子得到一个电子后3p轨道全充满
CC原子的p轨道半充满,它的气态氢化物能与其最高价氧化物的水化物反应生成一种常见的盐X
DD元素的最高化合价与最低化合价的代数和为零,其最高价氧化物为分子晶体
EE元素的核电荷数等于A元素和B元素氢化物的核电荷数之和
(1)元素Y是C下一周期同主族元素,比较B、Y元素的第一电离能I1(B) I1(Y)。
(2)E元素原子的核外电子排布式为
(3)盐X的水溶液呈 (填“酸性”、“碱性”或“中性”),B元素最高价含氧酸一定比D元素最高价含氧酸的酸性 (填“强”或“弱”)。
(4)C单质分子中σ键和π键的个数比为 ,C的氢化物在同族元素的氢化物中沸点出现反常,其原因是
(5)用高能射线照射液态H2A时,一个H2A分子能释放出一个电子,同时产生一种具有较强氧化性的阳离子,试写出该阳离子的电子式: ,
写出该阳离子与硫的氢化物的水溶液反应的离子方程式:
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 选修2化学与技术练习卷(解析版) 题型:填空题
锆产业是极有发展潜力及前景的新兴产业,锆(Zr)元素是核反应堆燃料棒的包裹材料,二氧化锆(ZrO2)可以制造耐高温纳米陶瓷。我国有丰富的锆英石(ZrSiO4),含Al2O3、SiO2、Fe2O3等杂质,生产锆流程之一如下:
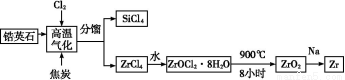
试回答下列问题:
(1)写出上述流程中高温气化的反应方程式(碳转化成CO): ;
(2)写出ZrOCl2·8H2O在900 ℃生成ZrO2的反应方程式 ;
(3)关于二氧化锆纳米陶瓷和锆合金的说法不正确的是 (单选)。
A.二氧化锆纳米陶瓷是新型无机非金属材料
B.1纳米=10-10米
C.锆合金的硬度比纯锆要高
D.日本福岛核电站的爆炸可能是由锆合金在高温下与水蒸气反应产生的氢气爆炸引起
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题9溶液中的电离平衡练习卷(解析版) 题型:选择题
将0.1 mol·L-1的氨水加水稀释至0.01 mol·L-1,稀释过程中温度不变,下列叙述正确的是( )
A.稀释后溶液中c(H+)和c(OH-)均减小
B.稀释后溶液中c(OH-)变为稀释前的1/10
C.稀释过程中氨水的电离平衡向左移动
D.稀释过程中溶液中 增大
增大
查看答案和解析>>
科目:高中化学 来源:2014高考化学名师知识点精编 专题5化学能与热能练习卷(解析版) 题型:选择题
在298 K、1.01×105 Pa下,将22 g CO2通入750 mL 1 mol·L-1NaOH溶液中充分反应,测得反应放出x kJ的热量。已知在该条件下,1 mol CO2通入1 L 2 mol·L-1 NaOH溶液中充分反应放出y kJ的热量。则CO2与NaOH溶液反应生成NaHCO3的热化学方程式为( )
A.CO2(g)+NaOH(aq) NaHCO3(aq) ΔH=-(2y-x)kJ·mol-1
NaHCO3(aq) ΔH=-(2y-x)kJ·mol-1
B.CO2(g)+NaOH(aq) NaHCO3(aq) ΔH=-(2x-y)kJ·mol-1
NaHCO3(aq) ΔH=-(2x-y)kJ·mol-1
C.CO2(g)+NaOH(aq) NaHCO3(aq) ΔH=-(4x-y)kJ·mol-1
NaHCO3(aq) ΔH=-(4x-y)kJ·mol-1
D.CO2(g)+NaOH(aq) NaHCO3(aq) ΔH=-(8x-2y)kJ·mol-1
NaHCO3(aq) ΔH=-(8x-2y)kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com