
| A. | CH4、NH3、HF | B. | OH-、F-、NH3 | C. | H3O+、NH4+、Mg2+ | D. | O2-、OH-、NH2- |
分析 根据原子的质子数相加即为微粒的质子数,阴离子中,电子数=质子数+电荷数,阳离子中,电子数=质子数-电荷数来分析解答.
解答 解:A、CH4、NH3、HF的质子数分别为10,10、10,电子数分别为10,10、10,故A正确;
B、OH-、F-、NH3的质子数分别为9、9、10,电子数分别为10、10、10,故B错误;
C、H3O+、NH4+、Mg2+的质子数都是11、11、12电子数都是10,故C错误;
D、O2-、OH-、NH2-的质子数分别为8、9、9,电子数都是10,故D错误;
故选A.
点评 本题考查微粒的质子数和电子数,明确质子数和电子数的计算及中性微粒中质子数等于电子数是解答本题的关键.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:填空题
| X | 动植物生长不可缺少的元素,是组成蛋白质的重要元素 |
| Y | 地壳中含量居第一位 |
| Z | 短周期中其原子半径最大 |
| Q | 生活中大量使用其合金制品,工业上可用电解其氧化物的方法制备 |
| M | 海水中大量富集的元素之一,其最高正化合价与负价的代数和为6 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 自然界中氢元素有三种同位素,它们的性质相同 | |
| B. | 三种同位素在化学反应中容易失去一个电子而呈+1价 | |
| C. | ${\;}_{1}^{1}$H原子失去一个电子后变成一个质子 | |
| D. | 氢在周期表中与碱金属同属ⅠA族 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
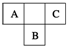 A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B原子核内质子数和中子数相等.
A、B、C为短周期元素,在周期表中所处的位置如图所示.A、C两元素的原子核外电子数之和等于B原子的质子数.B原子核内质子数和中子数相等.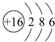 ,C的氢化物与B的氢化物的稳定性强弱顺序为HF>H2S(填化学式).
,C的氢化物与B的氢化物的稳定性强弱顺序为HF>H2S(填化学式).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
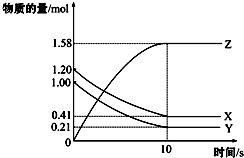
| A. | 反应开始到10s,用Z表示的反应速率为0.079mol/(L•s) | |
| B. | 该反应的方程式为:X(g)+Y(g)?2 Z(g) | |
| C. | 反应开始到10s时,Y的转化率为79.0% | |
| D. | 反应进行到10s时,该反应达到限度且各组分浓度相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 用过量氨水除去Al3+溶液中的少量Fe3+ | |
| B. | 将混合气体通过灼热的铜网除去N2中的少量O2 | |
| C. | 用新制的生石灰,通过加热蒸馏,以除去乙醇中的少量水 | |
| D. | 用饱和NaHCO3溶液除去混在H2中的HCl气体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
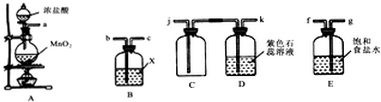
| 实验装置设计. |  (注明所用试剂及气体流向) (注明所用试剂及气体流向)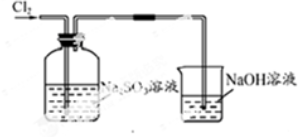 |
| 实验步驟及现象 | 连接好装置,将氯气通入亚硫酸钠溶液中,充分反应.取少量所得溶液与试管,滴入几滴氯化钡,有白色沉淀,再加入少量盐酸,沉淀不溶解. |
| 离子方程式 | Cl2+SO32-+H2O=2Cl-+SO42-+2H+; SO42-+Ba2+=BaSO4↓ |
| 结论 | Na2SO3具有还原性,能被氯气氧化成Na2SO4 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com