
| A. | NH3 | B. | (NH4)2SO4 | C. | Cl2 | D. | CH3CH2OH(乙醇) |
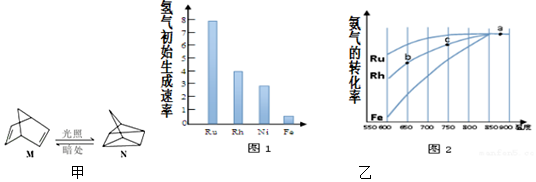
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 该材料耐高温、易导热、耐酸碱性强 | |
| B. | 该材料的主要成分也可用于制作太阳能电池板 | |
| C. | 网络通讯所用的光导纤维与该材料具有相同的化学成分 | |
| D. | 该光子晶体是平面网状结构,每隔Si与2个O成键,每个O与2个Si成键 |
查看答案和解析>>
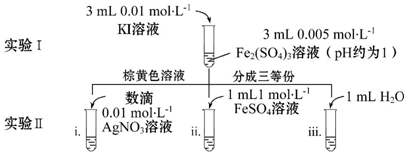
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2molSO2+1molO2 | B. | 2molSO2+1molO2+2molSO3 | ||
| C. | 4molSO2+1molO2 | D. | 3molSO2+0.5molO2+1molSO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 核外有13个电子,核内有13个质子 | |
| B. | 质量数为13,原子序数为6,核内有7个质子 | |
| C. | 136C与126C互为同位素 | |
| D. | 质量数为13,质子数为6,中子数为6 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com