
| A. | 1:2 | B. | 1:4 | C. | 2:1 | D. | 4:1 |
分析 先根据氧化还原反应中得失电子相等配平方程式,再根据化合价变化的和化合价不变的氮原子判断.
解答 解:该反应中,NH4+→N2氮元素的化合价由-3价→0价,生成一个氮气分子需要铵根离子失去6个电子,生成一个二氧化硫分子需要硫酸根离子得到2个电子,所以其最小公倍数是6,然后其它元素根据原子守恒进行配平方程式,所以该方程式为3(NH4)2SO4$\frac{\underline{\;强热\;}}{\;}$3SO2↑+N2↑+4NH3↑+6H2O,该方程式中铵根离子和氨气分子中氮原子的化合价都是-3价,化合价不变,所以该反应中化合价发生变化和未发生变化的N原子数之比为1×2:4×1=1:2,
故选A.
点评 本题考查了氧化还原反应、根据方程式进行有关计算,难度不大,注意该方程式中氧化剂和还原剂是同一种物质,但氧化产物和还原产物不同,所以从生成物进行配平较简便.


 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:填空题
| 分类标准 | 酸性氧化物 | 非电解质 | |
| 属于该类的物质 | ⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | CuSO4 | B. | NaCl | C. | CaCl2 | D. | 无 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 酸性氧化物都是非金属氧化物 | |
| B. | 乙醇和二甲醚分子式相同,结构不同,互为同素异形体 | |
| C. | 丁达尔效应可用于区别溶液与胶体 | |
| D. | 熔融状态能导电的物质一定是离子化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
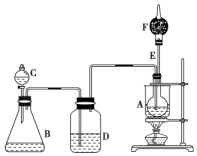 已知CH3CH2OH+NaBr+H2SO4CH3CH2Br+NaHSO4+H2O,如图是某校化学课外活动小组设计的乙醇与氢卤酸反应的实验装置图.
已知CH3CH2OH+NaBr+H2SO4CH3CH2Br+NaHSO4+H2O,如图是某校化学课外活动小组设计的乙醇与氢卤酸反应的实验装置图.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 再通入1molO2,平衡正向移动,平衡常数不变 | |
| B. | 降低温度,正反应速率先减小后增大 | |
| C. | 平衡时SO2气体的转化率为50% | |
| D. | 该条件下反应放出0.5QkJ的热量 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com