
【题目】下列有关说法中,不正确的是![]()
A.在![]() 的
的![]() 溶液中加入少量NaOH固体,
溶液中加入少量NaOH固体,![]() 与
与![]() 均增大
均增大
B.常温下,![]() 溶液的
溶液的![]() ,则
,则![]()
C.常温下,![]() 的某酸溶液中,若
的某酸溶液中,若![]() ,则溶液中由水电离出的
,则溶液中由水电离出的![]()
D.a![]() 的HCN溶液与b
的HCN溶液与b![]() 的NaOH溶液等体积混合,所得溶液中
的NaOH溶液等体积混合,所得溶液中![]() ,则a一定小于b
,则a一定小于b
 学业测评一课一测系列答案
学业测评一课一测系列答案 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案科目:高中化学 来源: 题型:
【题目】测定0.1 mol·L-1 Na2SO3溶液先升温再降温过程中的pH,数据如下。
时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
pH | 9.66 | 9.52 | 9.37 | 9.25 |
实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验,④产生白色沉淀多。
下列说法不正确的是
A. Na2SO3溶液中存在水解平衡:![]() +H2O
+H2O![]()
![]() +OH
+OH
B. ④的pH与①不同,是由于![]() 浓度减小造成的
浓度减小造成的
C. ①→③的过程中,温度和浓度对水解平衡移动方向的影响一致
D. ①与④的Kw值相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究晶体的结构对化学新材料的发现有着重要的价值。
(1)晶胞中任一个原子的中心位置均可用称之为原子分数坐标的三个分别小于1的数(x,y,z)来予以规定。某晶体的晶胞结构如图所示,1号原子坐标为(0,0,0),2号原子坐标为(1/3,2/3,0),该晶体的化学式为___________,该晶胞参数为:a = 250.4 pm, c = 666.1 pm,γ = 120o; 3号原子坐标为_____________,列出上述晶体中A和B两原子间的最小核间距的计算式为_____________。(不必算出数值,但需要化简)
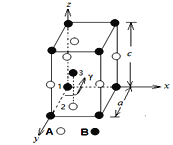
(2)体心立方堆积的晶胞是个立方体,如果半径为r的原子保持紧密接触,立方体的中心能容得下半径最大为___________的一个原子。
(3)Fe能形成多种氧化物,其中FeO晶胞结构为NaCl型。晶体中实际上存在空位、错位、杂质原子等缺陷,晶体缺陷对晶体的性质会产生重大影响。由于晶体缺陷,在晶体中Fe和O的个数比发生了变化,变为FexO(x<1),若测得某FexO晶体密度为5.71 g·cm-3,晶胞边长为4.28×10-10 m,则FexO中x=__________(结果保留两位有效数字)。
(4)钙钛矿晶体的结构如图所示。假设把氧离子看做硬球接触模型,钙离子和钛离子填充氧离子的空隙,氧离子形成正八面体,钛离子位于正八面体中心,则一个钛离子被__________个氧离子包围;钙离子位于立方晶胞的体心,一个钙离子被_____个氧离子包围。钙钛矿晶体的化学式为__________。若氧离子半径为a pm,则钙钛矿晶体中两个钛离子间最短距离为_______pm,钛离子与钙离子间最短距离为_______pm。

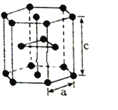
(5)钛元素有两种同素异形体,常温下是六方堆积,高温下是体心立方堆积。如图所示F晶体的结构中,晶胞参数a=0.295nm,c=0.469nm,则该F晶体的密度为_____________ g· cm-3
(用NA表示阿伏加德罗常数的值,列出计算式即可,不用化简)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是碳酸钙(CaCO3)在25 ℃和100 ℃两种情况下,在水中的沉淀溶解平衡曲线。下列有关说法正确的是( )
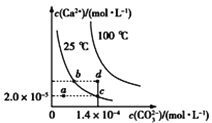
A.CaCO3(s)![]() Ca2+(aq)+CO32—(aq) ΔH<0
Ca2+(aq)+CO32—(aq) ΔH<0
B.a、b、c、d四点对应的溶度积Ksp相等
C.25 ℃时CaCO3的Ksp=2.8×10-9
D.温度不变,挥发水分,可使溶液由a点变到c点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。已知:p(Ba2+)=lgc(Ba2+),p(SO42)=lgc(SO42)。下列说法正确的是

A. 该温度下,Ksp(BaSO4)=1.0×1024
B. 加入BaCl2可以使溶液由c点变到a点
C. d点表示的是该温度下BaSO4的不饱和溶液
D. a点的Ksp(BaSO4)小于b点的Ksp(BaSO4)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(实验班)钡(Ba)和锶(Sr)及其化合物在工业上有着广泛的应用,它们在地壳中常以硫酸盐的形式存在,BaSO4和SrSO4都是难溶性盐。工业上提取钡和锶时首先将BaSO4和SrSO4转化成难溶弱酸盐。
已知:SrSO4(s)![]() Sr2+(aq)+SO
Sr2+(aq)+SO![]() (aq) Ksp=2.5×10-7
(aq) Ksp=2.5×10-7
SrCO3(s)![]() Sr2+(aq)+CO
Sr2+(aq)+CO![]() (aq) Ksp=2.5×10-9
(aq) Ksp=2.5×10-9
(1)将SrSO4转化成SrCO3的离子方程式为________________________________,该反应的平衡常数为__________________(填具体数字);该反应能发生的原因是
_________________________________________(用沉淀溶解平衡的有关理论解释)。
(2)对于上述反应,实验证明增大CO![]() 的浓度或降低温度都有利于提高SrSO4的转化率。判断在下列两种情况下,平衡常数K的变化情况(填“增大”、“减小”或“不变”):
的浓度或降低温度都有利于提高SrSO4的转化率。判断在下列两种情况下,平衡常数K的变化情况(填“增大”、“减小”或“不变”):
①升高温度,平衡常数K将________;②增大CO![]() 的浓度,平衡常数K将________。
的浓度,平衡常数K将________。
(3)已知,SrSO4和SrCO3在酸中的溶解性与BaSO4和BaCO3类似,设计实验证明上述过程中SrSO4是否完全转化成SrCO3。实验所用的试剂为________;实验现象及其相应结论为_________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】牙齿表面由一层硬的、组成为Ca5(PO4)3OH的物质保护着,它在唾液中存在下列溶解平衡:Ca5(PO4)3OH(s)![]() 5Ca2+(aq)+3 PO43—(aq)+OH(aq)。试回答问题:
5Ca2+(aq)+3 PO43—(aq)+OH(aq)。试回答问题:
(1)小孩吃糖后,如果不及时刷牙或漱口,细菌和酶就会作用于糖,在口腔内产生有机羧酸,久而久之,牙齿就会受到腐蚀,其原因是___________。
(2)已知Ca5 (PO4)3F(s)的溶解度比上述矿化产物Ca5(PO4)3OH的溶解度更小,质地更坚硬。当牙膏中配有氟化物添加剂后能防止龋齿,其原因是(用离子方程式和简要文字说明)___________。
(3)根据以上原理,请你提出一种其他促进矿化的方法:_________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】五倍子是一种常见的中草药,其有效成分为X,在一定条件下X可分别转化为Y、Z。

下列说法错误的是
A.1 mol Z最多能与7 mol NaOH发生反应
B.1 mol X最多能与2 mol Br2发生取代反应
C.Y分子结构中有3个手性碳原子
D.Y能发生加成、取代、消去、氧化、缩聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】今有室温下四种溶液,有关叙述不正确的是
序号 | ① | ② | ③ | ④ |
pH | 11 | 11 | 3 | 3 |
溶液 | 氨水 | 氢氧化钠溶液 | 醋酸 | 盐酸 |
A. ③④中分别加入适量的醋酸钠晶体后,两溶液的pH均增大
B. ②③两溶液等体积混合,所得溶液中c(H+)>c(OH-)
C. 分别加水稀释10倍,四种溶液的pH①>②>④>③
D. V1L④与V2L①溶液混合后,若混合后溶液pH=7,则V1<V2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com