

分析 由流程可知,②中加氯化钡可除去硫酸根离子,③中加NaOH除去镁离子,④中加碳酸钠可除去钡离子、钙离子,过滤后主要为氯化钠和碳酸钠,⑥中加盐酸反应后溶液中溶质为NaCl,然后蒸发结晶得到NaCl,
(1)根据钡离子能和硫酸根之间反应生成硫酸钡沉淀来检验氯化钡是否过量;
(2)NaOH除去镁离子据此进行分析;
(3)溶液中加入足量的盐酸溶液,除去过量的碳酸根和氢氧根,据此回答.
解答 解:由流程可知,②中加氯化钡可除去硫酸根离子,③中加NaOH除去镁离子,④中加碳酸钠可除去钡离子、钙离子,过滤后主要为氯化钠和碳酸钠,⑥中加盐酸反应后溶液中溶质为NaCl,然后蒸发结晶得到NaCl,
(1)过量的氯化钡会将全部的硫酸根离子沉淀完毕,只要是硫酸根剩余,则氯化钡会与其反应出现白色沉淀,所以判断BaCl2已过量的方法是:取第②步后的上层清液1~2滴,(或取少量上层清液于试管中),再滴入1~2滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量,
故答案为:取第②步后的上层清液1~2滴,(或取少量上层清液于试管中),再滴入1~2滴BaCl2溶液,若溶液未变浑浊,则表明BaCl2已过量;
(2)氯化镁和氢氧化钠反应生成硫酸钡沉淀,故反应化学方程式为MgCl2+2NaOH═Mg(OH)2↓+2NaCl,
故答案是:MgCl2+2NaOH═Mg(OH)2↓+2NaCl;
(3)溶液中加入足量的盐酸溶液,除去过量的碳酸根和氢氧根,即2HCl+Na2CO3=2NaCl+H2O+CO2↑,HCl+NaOH=NaCl+H2O,
故答案为:2HCl+Na2CO3=2NaCl+H2O+CO2↑;HCl+NaOH=NaCl+H2O.
点评 本题主要考查了粗盐提纯过程中的除杂方面的知识,要注意除杂质的顺序以及加入的试剂所发生的反应,难度不大.


 世纪百通主体课堂小学课时同步达标系列答案
世纪百通主体课堂小学课时同步达标系列答案 世纪百通优练测系列答案
世纪百通优练测系列答案 百分学生作业本题练王系列答案
百分学生作业本题练王系列答案科目:高中化学 来源: 题型:选择题
| A. | 铁与稀盐酸制取氢气时,加入NaNO3固体或Na2SO4固体都不影响生成氢气的速率 | |
| B. | 加入反应物,则单位体积内活化分子百分数增大,化学反应速率增大 | |
| C. | 过程的自发性只能用于判断其方向性,不能确定其是否一定会发生和发生的速率 | |
| D. | 中和反应放热说明中和反应前后能量不守恒 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水是弱电解质 | B. | 可燃冰是可以燃烧的水 | ||
| C. | 氢氧两种元素只能组成水 | D. | 0℃时冰的密度比液态水的密度大 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,其工作原理如图所示.电池总反应是:Mg+H2O2+2H+═Mg2++2H2O
Mg-H2O2电池可用于驱动无人驾驶的潜航器.该电池以海水为电解质溶液,其工作原理如图所示.电池总反应是:Mg+H2O2+2H+═Mg2++2H2O查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 常温下,向0.l mol.L-lNa2A溶液中,不断通入HC1,H2A、HA-、A2-在溶液中所占物质的量分数(δ)与pOH[pOH=-lgc(OH-)]的关系如图所示,下列说法正确的是( )
常温下,向0.l mol.L-lNa2A溶液中,不断通入HC1,H2A、HA-、A2-在溶液中所占物质的量分数(δ)与pOH[pOH=-lgc(OH-)]的关系如图所示,下列说法正确的是( )| A. | H2A的第二级电离平衡常数为l0-l0mol/L | |
| B. | 随着HCl的通入,$\frac{c({H}^{+})}{c({H}_{2}A)}$先减小后增大 | |
| C. | 当溶液呈中性时:c(Na+)═c(HA-)+2c (A2-) | |
| D. | 将等浓度等体积的Na2A与H2A溶液混合后,溶液显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 ,它在一定条件下可能发生的反应是( )
,它在一定条件下可能发生的反应是( )| A. | ①③④⑤⑦ | B. | ①③④⑤⑥⑦ | C. | ①③⑤⑥⑦ | D. | ②③④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 富脂食品包装中常放入活性铁粉袋,以防止油脂氧化变质 | |
| B. | 目前科学家已经制得单原子层锗,其电子迁移率是硅的10倍,有望取代硅用于制造晶体管 | |
| C. | Ni-Zn化合物的纳米颗粒可作 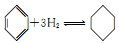 反应的催化剂,提高苯的转化率 反应的催化剂,提高苯的转化率 | |
| D. | 用K2FeO4代替Cl2处理饮用水时,既有杀菌消毒作用,又有净水作用 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
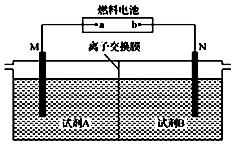 以二甲醚(CH3OCH3)酸性燃料电池为电源,电解饱和食盐水制备氯气和烧碱,设计装置如图所示.已知:a电扱的反应式为O2+4H++4e-═2H2O,下列说法不正确的是( )
以二甲醚(CH3OCH3)酸性燃料电池为电源,电解饱和食盐水制备氯气和烧碱,设计装置如图所示.已知:a电扱的反应式为O2+4H++4e-═2H2O,下列说法不正确的是( )| A. | b电极的反应式为CH3OCH3+3H2O-12e-═2CO2↑+12H+ | |
| B. | 试剂A为饱和食盐水,试刑B为NaOH稀溶液 | |
| C. | 阳极生成1 mol气体时,有1mol离子通过离子交换膜 | |
| D. | 阴极生成1 mol气体时,理论上导线中流过2 mol e- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com