

| A. | 氯气 | B. | ClO2 | C. | NaCl | D. | NaClO3 |
分析 A、Cl2+H2O?HClO+HCl,产物的中次氯酸强氧化性;
B、二氧化氯中氯是+4价,具有强氧化性;
C、自来水中加入氯化钠使自来水变咸;
D、氯酸钠加入自来水引入杂质离子钠离子和氯酸根离子,而在酸性条件下才具有强氧化性.
解答 解:A、氯气能和水反应生成盐酸和次氯酸,次氯酸具有强氧化性,能够杀菌消毒,所以氯气可以,故A正确;
B、二氧化氯中氯是+4价,是一种高效的消毒剂,所以可以杀菌消毒,故B正确;
C、自来水中加入氯化钠使自来水变咸,无杀毒效果,故C错误;
D、氯酸钠加入自来水引入杂质离子钠离子和氯酸根离子,中性水无氧化性,故D错误;
故选AB.
点评 本题考查氯气和二氧化氯的化学性质,强氧化性常用来作为自来水的漂白剂,学生平时要注意对生活常识的积累,比较容易.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
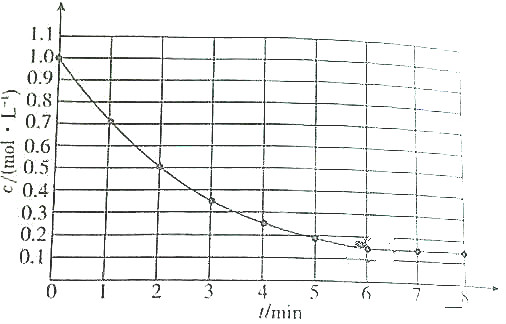
| A. | 第6min后,生成A的平均速率为0mol/(L•min) | |
| B. | A的平衡转化率为85% | |
| C. | 升高温度时,生成A的平均速率大于消耗A的平均速率 | |
| D. | 降低温度时,生成A的平均速率和消耗A的平均速率以不同倍数减少 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 现象或事实 | 分析 |
| A | 发电厂将燃煤产生的废气通入高温下的石灰石 | 主要目的是生产CaSO4并得到副产品CO2 |
| B | ClO2代替Cl2对饮用水消毒 | ClO2消毒杀毒效率高,二次污染小 |
| C | 苏打、苛性钠可用于治疗胃酸过多 | 苏打、苛性钠都与胃酸反应 |
| D | 用环保绿色融雪除冰剂代替氯化钙、氯化钠融雪除冰 | 氯化钙、氯化钠会造成环境污染,但不会加速桥梁等设备腐蚀 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na、Mg、Al原子的失电子能力依次增强 | |
| B. | Li、Na、K的最高价氧化物对应的水化物的碱性依次减弱 | |
| C. | Si、P、S元素的气态氢化物的稳定性依次降低 | |
| D. | C、N、O的原子半径依次减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7.1% | B. | 35.5% | C. | 28.4% | D. | 42.6% |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 溶液中由水电离的氢离子浓度为10-4 | |
| B. | 与pH=4的盐酸等体积混合后,c(Cl-)>c(NH4+) | |
| C. | 通入一定量氨气后,依然存在c(NH4+)+c(H+)=c(OH-) | |
| D. | 氨水中存在:c(NH3•H2O)>c(NH4+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 二者不可能是同系物 | |
| B. | 二者一定是同分异构体 | |
| C. | 各1mol的A和B分别燃烧生成CO2的质量一定相等 | |
| D. | 二者最简式相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com