
【题目】根据原子核外电子排布规则,回答下列问题:
(1)写出基态S原子的核外电子排布式___________________________________,写出基态24Cr原子的价电子排布式________________________;
(2)写出基态N的原子核外电子排布图:__________________;
(3)若将基态14Si的电子排布式写成1s22s22p63s33p1,则它违背了_______________________;
(4)Fe3+比Fe2+的稳定性更________(填“强”或“弱”),从结构上分析原因是____________________________________________________________________________。
【答案】1s22s22p63s23p4或[Ne]3s23p43d54s1![]() 泡利原理强Fe3+的价电子排布为3d5,处于“半满状态”,故更稳定
泡利原理强Fe3+的价电子排布为3d5,处于“半满状态”,故更稳定
【解析】
(1)S位于第三周期第VIA族,核外电子排布式为1s22s22p63s23p4或[Ne]3s23p4;Cr属于过渡元素,价电子包括最外层和次外层的d能级,即Cr的价电子排布式为3d54s1;(2)N位于第二周期VA族,根据泡利原理和洪特规则,核外电子排布图为![]() ;(3)s能级上只有一个原子轨道,每个原子轨道最多容纳2个电子,而题目所给的电子排布式中的3s上有3个电子,违背了泡利(不相容)原理;(4)Fe2+的价电子排布式为3d6 ,Fe3+的价电子排布为3d5,处于“半满状态”,因此Fe3+比Fe2+稳定。
;(3)s能级上只有一个原子轨道,每个原子轨道最多容纳2个电子,而题目所给的电子排布式中的3s上有3个电子,违背了泡利(不相容)原理;(4)Fe2+的价电子排布式为3d6 ,Fe3+的价电子排布为3d5,处于“半满状态”,因此Fe3+比Fe2+稳定。


 步步高达标卷系列答案
步步高达标卷系列答案科目:高中化学 来源: 题型:
【题目】①![]() 和
和![]() ②红磷和白磷 ③
②红磷和白磷 ③![]() 和
和![]() ④
④![]() 和
和![]() ⑤
⑤![]() 和
和![]() ⑥
⑥ 和
和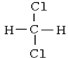
(1)属于同素异形体的是________(2)互为同位素的是________
(3)互为同分异构体的是________(4)属于同系物的是________
(5)属于同种物质的是________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:C(s)+O2(g)===CO2(g) ΔH1
CO2(g)+C(s)===2CO(g) ΔH2
2CO(g)+O2(g)===2CO2(g) ΔH3
4Fe(s)+3O2(g)===2Fe2O3(s) ΔH4
3CO(g)+Fe2O3(s)===3CO2(g)+2Fe(s) ΔH5
下列关于上述反应焓变的判断正确的是
A. ΔH1>0,ΔH3<0B. ΔH2>0,ΔH4>0C. ΔH1=ΔH2+ΔH3D. ΔH3=ΔH4+ΔH5
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】随原子序数递增,八种短周期元素(用字母x等表示)原子半径的相对大小、最高正价或最低负价的变化如下图所示。

根据判断出的元素回答问题:
(1)f在周期表中的位置是___________。
(2)比较d、e常见离子的半径大小(用化学式表示,下同):______>______;比较g、h的最高价氧化物对应水化物的酸性强弱:_______。
(3)写出一种既含离子键又含极性共价键e的氧化物的电子式:_____。
(4)已知1 gX的单质在足量d2中燃烧,恢复至室温,放出142.9kJ热量,写出表示其燃烧热的热化学方程式:____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列各组物质:
A. O2和O3(臭氧) B. ![]() 和
和![]() C. CH3-CH2-CH2-CH3和
C. CH3-CH2-CH2-CH3和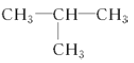
D. 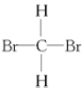 和
和 E. 甲烷和庚烷 F.
E. 甲烷和庚烷 F.  与C(CH3)4
与C(CH3)4
G. CH3COOH与HCOOCH3 H. 金刚石与石墨
(1)______________组两种核素互为同位素;
(2)______________组两物质互为同素异形体;
(3)______________组两物质属于同系物;
(4)______________组两物质互为同分异构体;
(5)______________组两物质互属于同一种物质。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在容积为2L的密闭容器中,某可逆反应在不同反应时间各物质的量的变化情况如图所示。
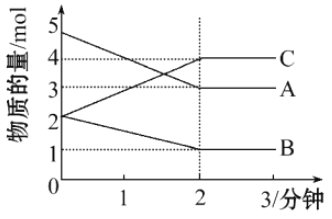
(1)则该反应的的反应物是______,生成物是_____;
(2)该反应的化学方程式为___________;
(3)从反应开始至2分钟时,用C表示其反应速率为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1mol酯R完全水解可得到l molC5H8O4和2mol甲醇,下列有关酯R的分子式和分子结构数目正确的是
A. C7H12O4,4种 B. C7H12O4,6种
C. C7H14O2,8 种 D. C7H14O2,10种
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com