
福岛核电站泄漏的放射性物质中含有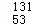 I,下列有关
I,下列有关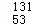 I的说法正确的是()
I的说法正确的是()
A. 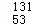 I是碘元素的一种同位素
I是碘元素的一种同位素
B. 由此可确定碘元素的相对原子质量为131
C. 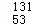 I核素中含中子数为53
I核素中含中子数为53
D. 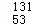 I2的摩尔质量为262 g
I2的摩尔质量为262 g
考点: 同位素及其应用;质量数与质子数、中子数之间的相互关系.
专题: 原子组成与结构专题.
分析: 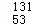 I的质子数位53,质量数为131,质子数+中子数=质量数,则该碘原子的中子数=131﹣53=78;具有相同质子数而中子数不同的同种元素的原子互为同位素,该碘原子为碘元素的一种同位素;摩尔质量的单位为g/mol,该碘单质的摩尔质量为262g/mol,据此进行解答.
I的质子数位53,质量数为131,质子数+中子数=质量数,则该碘原子的中子数=131﹣53=78;具有相同质子数而中子数不同的同种元素的原子互为同位素,该碘原子为碘元素的一种同位素;摩尔质量的单位为g/mol,该碘单质的摩尔质量为262g/mol,据此进行解答.
解答: 解:A.具有相同质子数而中子数不同的同种元素的原子互为同位素,该碘原子为碘元素的不同核素,即该碘原子为碘元素的一种同位素,故A正确;
B.该碘原子的相对原子质量为131,而碘元素的相对原子质量与各同位素原子的含量有关,需要根据各同位素的含量进行计算,故B错误;
C.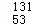 I的质子数位53,质量数为131,含中子数为131﹣53=78,故C错误;
I的质子数位53,质量数为131,含中子数为131﹣53=78,故C错误;
D.该碘单质的相对分子量为262,其摩尔质量为262g/mol,故D错误;
故选A.
点评: 本题考查了同位素、原子结构、摩尔质量与质量、相对分子量的关系,题目难度不大,注意掌握同位素、摩尔质量的概念,明确原子中质量数=质子数+中子数,选项B为易错点,注意元素的相对原子量与该元素的各种核素的含量有关.


科目:高中化学 来源: 题型:
在含有Cu(NO3)2、Zn(NO3)2、AgNO3各0.1mol的混合溶液中加入0.1molFe粉,充分搅拌后铁溶解,溶液中不在Fe3+离子,同时析出0.1molAg.则下列结论中不正确的是()
A. 氧化性:Ag+>Cu2+>Zn2+
B. 溶液中Cu2+与Fe2+的物质的量之比为1:1
C. Ag+的最先与Fe反应
D. 1molFe可还原1molCu2+
查看答案和解析>>
科目:高中化学 来源: 题型:
某实验小组只领取下列仪器或用品:铁架台、铁圈、铁夹、三角架、石棉网、烧杯、分液漏斗、酒精灯、玻璃棒、量筒、蒸发皿、蒸馏烧瓶、火柴、滤纸、漏斗.只应用上述仪器或用品,不能进行的实验操作是()
A. 蒸发 B. 萃取 C. 过滤 D. 蒸馏
查看答案和解析>>
科目:高中化学 来源: 题型:
用98%的浓硫酸(密度为1.84g/cm3)配制100mL 1 mol/L的稀硫酸.现给出下列仪器(配制过程中可能用到):①100mL量筒 ②10mL量筒 ③50mL烧杯 ④托盘天平 ⑤100mL容量瓶 ⑥胶头滴管 ⑦玻璃棒,按使用仪器的先后顺序排列正确的是()
A. ④③⑦⑤⑥ B. ②⑤⑦⑥ C. ①③⑤⑥⑦ D. ②⑥③⑦⑤⑥
查看答案和解析>>
科目:高中化学 来源: 题型:
氨气具有广泛的用途.
(1)工业上合成氨反应的化学方程式是N2+3H2 2NH3.
2NH3.
(2)实验室常用如图所示装置制取并收集氨气.
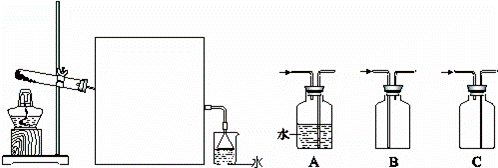
①实验室制取氨气反应的化学方程式是 .
②图中方框内收集氨气的装置可选用 (填字母序号).
③尾气处理装置中使用倒扣漏斗的作用是 .
(3)工业上用NH3制取NO反应的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
可逆反应N2(g)+3H2(g)⇌2NH3(g)达到平衡状态,下列说法中正确的是()
A. 该反应停止,N2和H2不再化合
B. N2、H2、NH3浓度不变
C. N2、H2、NH3浓度相等
D. N2、H2、NH3的物质的量之比为1:3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
电池是人类生产和生活中重要的能量来源.各式各样电池的发明是化学对人类的一项重大贡献.下列有关电池的叙述正确的是()
A. 锌锰干电池工作一段时间后碳棒变细
B. 氢氧燃料电池可将热能直接转变为电能
C. 氢氧燃料电池工作时氢气在负极被氧化
D. 太阳能电池的主要材料是高纯度的二氧化硅
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com