
A.只有②不正确 B.②③④不正确
C.①③④正确 D.全部正确
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
| 元素 | A | B | C | D |
| 性质 结构 信息 |
单质在氯气中燃烧火焰呈黄色,产生大量白烟,所得产物的阳离子与E的阳 离子电子数相同. |
单质是带有金属光泽的灰黑色固体,是信息技术的 关键材料. |
最高价氧化物的水化物与其气态氢化物反应得到离子化合物E. | 氧化物是一种耐火材料,能溶于A的最高价氧化物的水化物得 到化合物F. |
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
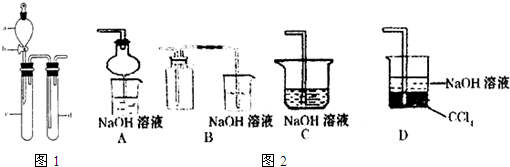
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
 SO2是一种重要的化工原料,也是引起酸雨污染的重要来源.
SO2是一种重要的化工原料,也是引起酸雨污染的重要来源.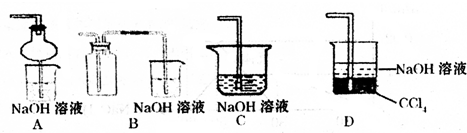
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、用无水乙醇提取碘水中的碘单质 | B、加入稀HNO3和BaCl2溶液产生白色沉淀的溶液中一定含SO42- | C、可用FeCl3溶液一次性鉴别CCl4、苯酚溶液、NaI溶液和NaCl溶液 | D、玻璃棒在配制0.1mol/L NaCl溶液与粗盐提纯的实验中所起的作用相同 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com