
| A. | 醋酸溶液与氢氧化钠溶液反应:CH3COOH+OH-═CH3COO-+H2O | |
| B. | 碳酸氢钠与盐酸反应:CO32-+2H+═H2O+CO2↑ | |
| C. | 铁与稀硫酸反应:Fe+2H+═Fe3++H2↑ | |
| D. | 钠与水反应:Na+2H2O═Na++2OH-+H2↑ |
分析 A.醋酸与氢氧化钠溶液反应生成醋酸钠和水,醋酸需要保留分子式;
B.碳酸氢钠电离出碳酸氢根离子和钠离子,碳酸氢根离子不能拆开;
C.铁与稀硫酸反应生成硫酸亚铁和氢气;
D.2mol钠与水反应生成1mol氢气,该反应不满足电子守恒.
解答 解:A.醋酸为弱电解质,离子方程式中需要保留分子式,则醋酸溶液与氢氧化钠溶液反应的离子方程式为:CH3COOH+OH-═CH3COO-+H2O,故A正确;
B.碳酸氢钠与盐酸反应生成二氧化碳气体、氯化钠和水,碳酸氢根离子不能拆开,正确的离子方程式为:HCO3-+H+═H2O+CO2↑,故B错误;
C.铁与稀硫酸反应生成的是亚铁离子,正确的离子方程式为:Fe+2H+═Fe2++H2↑,故C错误;
D.Na与水反应生成氢氧化钠和氢气,该反应不满足电子守恒、电荷守恒,正确的离子方程式为:2Na+2H2O═2Na++2OH-+H2↑,故D错误;
故选A.
点评 本题考查了离子方程式的正误判断,为高考的高频题,题目难度中等,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.


 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 质量数是3 | B. | 质子数是3 | C. | 中子数是1 | D. | 电子数是2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
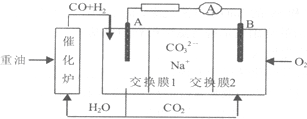
| A. | 重油是石油分馏的产品,含有的主要元素为C、H、O | |
| B. | 电极B上发生的电极反应为:O2+2CO2+4e-═2CO32- | |
| C. | 电极A上H2参与的电极反应为:H2+2OH--2e-═2H2O | |
| D. | 电池工作时,CO32-向电极B移动 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 加催化剂,v正、v逆 都发生变化,且变化的倍数相等 | |
| B. | 加压,v正、v逆 都增大,且v正 增大的倍数大于V逆增大的倍数 | |
| C. | 增大氮气的浓度,H2的平衡转化率增大 | |
| D. | 降温,v正、v逆 都减小,且v正 减小的倍数大于v逆减小的倍数 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验编号 | 温 度(℃) | 催化剂用量(g) | 酸性高锰酸钾溶液 | 实验目的 a.实验1和2探究 探究不同温度对反应速率的影响 b.实验1 和3 探究反应物浓度对该反应速率的影响; c.实验1 和4 探究催化剂对该反应速率的影 响. | |
| 体积(mL) | 浓度 (mol•L-1) | ||||
| 1 | 25 | 0.5 | 4 | 0.1000 | |
| 2 | 50 | 0.5 | 4 | 0.1000 | |
| 3 | 25 | 0.5 | 4 | 0.0100 | |
| 4 | 25 | 0 | 4 | 0.1000 | |
| 实验编号 | 溶液褪色所需时间(min) | ||
| 第1 次 | 第2 次 | 第3 次 | |
| 1 | 14.0 | 13.0 | 11.0 |
| 3 | 6.5 | 6.7 | 6.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
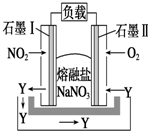 熔融盐NaNO3组成的燃料电池如图所示,在使用过程中石墨Ⅰ电极反应生成一种氧化物Y,下列有关说法正确的是( )
熔融盐NaNO3组成的燃料电池如图所示,在使用过程中石墨Ⅰ电极反应生成一种氧化物Y,下列有关说法正确的是( )| A. | 石墨Ⅰ极为正极,石墨Ⅱ极为负极 | |
| B. | Y的化学式可能为NO | |
| C. | 石墨Ⅰ极的电极反应式为NO2+NO${\;}_{3}^{-}$-e-═N2O5 | |
| D. | 石墨Ⅱ极上发生氧化反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 装置 | 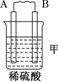 | 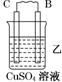 | 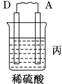 |
| 现象 | 二价金属A不断溶解 | C的质量增加 | A上有气体产生 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com