
| 1 |
| 2 |


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
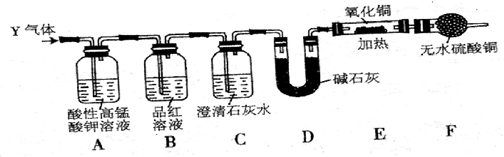
查看答案和解析>>
科目:高中化学 来源: 题型:
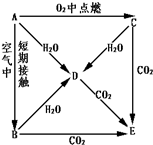 A、B、C、D、E五种物质都含1~18号元素中的某一元素,它们按如图所示关系相互转化,已知A金属为单质,C的焰色呈黄色.
A、B、C、D、E五种物质都含1~18号元素中的某一元素,它们按如图所示关系相互转化,已知A金属为单质,C的焰色呈黄色.查看答案和解析>>
科目:高中化学 来源: 题型:
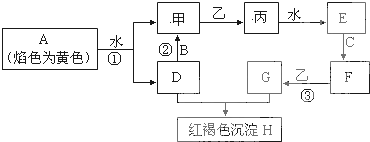
查看答案和解析>>
科目:高中化学 来源: 题型:
| +X一定条件 |
| 反应① |
| +X一定条件 |
| 反应② |
查看答案和解析>>
科目:高中化学 来源: 题型:
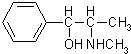 (1)药品分为处方药和非处方药.处方药是指必须在医生监控或指导下使用的药物,用符号
(1)药品分为处方药和非处方药.处方药是指必须在医生监控或指导下使用的药物,用符号查看答案和解析>>
科目:高中化学 来源: 题型:
| A、在c(H+)=10-10mol/L的溶液中 Al3+、NH4+、Cl-、NO3- |
| B、使甲基橙呈红色的溶液 Fe3+、Na+、SO42-、NO3- |
| C、水电离出来的c(H+)=10-12mol/L的溶液 K+、HCO3-、Cl-、ClO- |
| D、含Al3+、CO32-、Na+、AlO2-的溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、21:5 | B、11:3 |
| C、3:1 | D、4:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com