
·ÖĪö £Ø1£©øł¾ŻĀĮŗĶŃõĘų·“Ӧɜ³ÉŃõ»ÆĀĮ½ųŠŠ·ÖĪö£»
£Ø2£©øł¾ŻĀĮµÄ½šŹō»ī¶ÆŠŌ±ČĶ”¢ĢśĒ棬ĖłŅŌĮņĖįĀĮ²»»įÓėĢś”¢Ķ·“Ó¦½ųŠŠ·ÖĪö£»
£Ø3£©øł¾ŻĀĮµÄ»ī¶ÆŠŌ×īĒ棬Ęä“ĪŹĒĢś£¬ĶµÄ»ī¶ÆŠŌ×ī²»»īĘĆ£¬ĖłŅŌŅ»¶Ø·¢ÉśµÄŹĒĀĮŗĶĮņĖįĶ·“Ӧɜ³ÉĮņĖįĀĮŗĶĶ½ųŠŠ·ÖĪö£®
½ā“š ½ā£ŗ£Ø1£©ĀĮŗĶŃõĘų·“Ӧɜ³ÉŃõ»ÆĀĮ£¬»Æѧ·½³ĢŹ½ĪŖ£ŗ4Al+3O2=2Al2O3£¬¹Ź“š°øĪŖ£ŗ4Al+3O2=2Al2O3£»
£Ø2£©ĀĮµÄ½šŹō»ī¶ÆŠŌ±ČĶ”¢ĢśĒ棬ĖłŅŌĮņĖįĀĮ²»»įÓėĢś”¢Ķ·“Ó¦£¬ĖłŅŌŅ»¶Ø²»Äܹ»Ń”ŌńµÄÓŠ¢Ś£¬¹Ź“š°øĪŖ£ŗ¢Ś£»
£Ø3£©ĀĮµÄ»ī¶ÆŠŌ×īĒ棬Ęä“ĪŹĒĢś£¬ĶµÄ»ī¶ÆŠŌ×ī²»»īĘĆ£¬ĖłŅŌŅ»¶Ø·¢ÉśµÄŹĒĀĮŗĶĮņĖįĶ·“Ӧɜ³ÉĮņĖįĀĮŗĶĶ£¬»Æѧ·½³ĢŹ½ĪŖ£ŗ2Al+3CuSO4=Al2£ØSO4£©3+3Cu£¬³ä·Ö·“Ó¦ŗó£¬ČÜŅŗĪŖĪŽÉ«£¬ŌņČŻĘ÷ÄŚŅ»¶Øŗ¬ÓŠµÄ¹ĢĢåÓŠĶ£®¹Ź“š°øĪŖ£ŗ2Al+3CuSO4=Al2£ØSO4£©3+3Cu£¬Ķ£®
µćĘĄ ŌŚ½ā“ĖĄąĢāŹ±£¬Ź×ĻČ·ÖĪöÓ¦ÓƵÄŌĄķ£¬Č»ŗóÕŅ³ö·“Ó¦Īļ”¢Éś³ÉĪļ£¬×īŗó½įŗĻ·½³ĢŹ½µÄŹéŠ“¹ęŌņŹéŠ“·½³ĢŹ½£®


 ŌĶĮæģ³µĻµĮŠ“š°ø
ŌĶĮæģ³µĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŹµŃéĢā
| ŠņŗÅ | ŹµŃé·½°ø | ŹµŃéĻÖĻó |
| ¢Ł | ĻņŹ¢ÓŠÉŁĮæäå»ÆÄĘČÜŅŗµÄŹŌ¹ÜÖŠµĪ¼ÓÉŁĮæŠĀÖĘĀČĖ®£¬Õńµ“£¬ŌŁ¼ÓČėÉŁĮæĖÄĀČ»ÆĢ¼£¬Õńµ“ŗó¾²ÖĆ | ŅŗĢå·ÖĪŖĮ½²ć£¬ĻĀ²ć³Ź³ČŗģÉ« |
| ¢Ś | ĻņŹ¢ÓŠÉŁĮæµā»ÆÄĘČÜŅŗµÄŹŌ¹ÜÖŠµĪ¼ÓÉŁĮæŠĀÖĘäåĖ®£¬Õńµ“£¬ŌŁ¼ÓČėÉŁĮæĖÄĀČ»ÆĢ¼£¬Õńµ“ŗó¾²ÖĆ | ŅŗĢå·ÖĪŖĮ½²ć£¬ĻĀ²ć³Ź×ĻŗģÉ« |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¢Ś¢Ū¢ß¢Ż¢Ž | B£® | ¢Ś¢Ż¢ß¢Ž | C£® | ¢Ł¢Ū¢Ż¢ß¢Ü¢Ž | D£® | ¢Ü¢Ū¢ß¢Ż¢Ž |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ŅŅČ²·Ö×ÓµÄĒņ¹÷Ä£ŠĶ£ŗ | B£® | ōĒ»łµÄµē×ÓŹ½£ŗ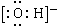 | ||
| C£® | 2ĀȱūĶéµÄ½į¹¹¼ņŹ½£ŗCH3CHClCH3 | D£® | ±ūĻ©µÄ¼üĻߏ½£ŗ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ¶”“ļ¶ūĻÖĻóŹĒ»Æѧ±ä»Æ | |
| B£® | ÄĘÄÜÓėĮņĖįĶĻ”ČÜŅŗ·“Ó¦£¬ÖĆ»»³öŗģÉ«µÄĶ | |
| C£® | ¶ØČŻŹ±£¬Ņņ²»É÷Ź¹ŅŗĆęøßÓŚČŻĮæĘæµÄæĢ¶ČĻߣ¬ŠčÖŲŠĀÅäÖĘ | |
| D£® | ĒāŃõ»ÆĢś½ŗĢåŌŚÖ±Į÷µē³”ÖŠ£¬Ņ»¶ĪŹ±¼äŅõ¼«ø½½üŗģŗÖÉ«¼ÓÉī£¬ĖµĆ÷½ŗĢå“ųÕżµē |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | ·ÅµēŹ±£¬øŗ¼«ÉĻFe·¢Éś»¹Ō·“Ó¦ | |
| B£® | ·ÅµēŹ±£¬Õż¼«·“Ó¦ŹĒ£ŗNiO2+2e-+2H+=Ni£ØOH£©2 | |
| C£® | ·ÅµēŹ±£¬Ni£ØOH£©2ŹĒ»¹Ō²śĪļ | |
| D£® | øĆŠīµē³Ų·Åµē¹ż³ĢŗĶ³äµē¹ż³Ģ·¢ÉśµÄŹĒæÉÄę·“Ó¦ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | CO2·Ö×ӵĽį¹¹Ź½£ŗO=C=O | B£® | NaClµÄµē×ÓŹ½£ŗ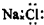 | ||
| C£® | N2µÄ½į¹¹Ź½£ŗ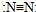 | D£® | FµÄŌ×Ó½į¹¹Ź¾ŅāĶ¼£ŗ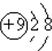 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

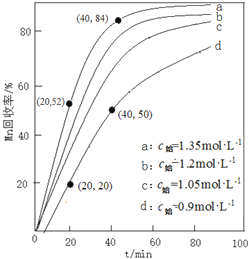
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com