
| A. | CH3CH2CH═CHCH2CH3 | B. | CH2═CHCH2CH2CH3 | ||
| C. | CH3CH═CHCH2CH2CH3 | D. | 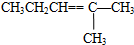 |
分析 烯烃在一定条件下发生氧化反应时,碳碳双键发生断裂,RCH═CHR1可以氧化成RCHO和R1CHO,在反应中碳碳双键断裂转化为醛基,在该条件下烯烃分别被氧化后,产物中可能有乙醛,说明该有机物中存在R-CH=CHCH3的结构.
解答 解:烯烃在一定条件下发生氧化反应时,碳碳双键发生断裂,RCH═CHR1可以氧化成RCHO和R1CHO,在反应中碳碳双键断裂转化为醛基,在该条件下烯烃分别被氧化后,产物中可能有乙醛,说明该有机物中存在R-CH=CHCH3的结构,
A.该物质被氧化生成丙醛,故A错误;
B.该物质被氧化生成甲醛和丁醛,故B错误;
C.该物质被氧化生成乙醛和丁醛,故C正确;
D.该物质被氧化生成丙醛和丙酮,故D错误;
故选C.
点评 本题考查有机物结构和性质,为高频考点,侧重考查学生知识迁移能力,正确理解烯烃被氧化断键和成键方式是解本题关键,采用知识迁移的方法分析解答即可,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 汽油是纯净物,乙醇汽油是混合物 | |
| B. | 苯、乙烯、乙酸和乙酸乙酯都能发生加成反应 | |
| C. | 石油的分馏和煤的干馏都发生了化学变化 | |
| D. | 除去乙酸乙酯中少量的乙酸,用饱和碳酸钠溶液洗涤后分液 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 图为制取纯净干燥的气体A的装置图的一部分.生成A的速度可通过滴入液体B的速度控制.已知A是一种无色、无气味的气体,它不能使酸碱指示剂变色,也不能在空气中燃烧,但能使带火星的木条复燃.
图为制取纯净干燥的气体A的装置图的一部分.生成A的速度可通过滴入液体B的速度控制.已知A是一种无色、无气味的气体,它不能使酸碱指示剂变色,也不能在空气中燃烧,但能使带火星的木条复燃.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 自然界中金属硫化物之间存在原电池反应,下图所示装置中电极I为方铅矿(PbS),电极Ⅱ为含有方铅矿的硫铁矿,当有电解质溶液按如图所示方向流经该装置时,电流表指针偏转.若电极Ⅱ质量不断减少,a处溶液中加入KSCN溶液未出现红色,加入CuSO4溶液未出现黑色沉淀.下列有关说法中正确的是( )
自然界中金属硫化物之间存在原电池反应,下图所示装置中电极I为方铅矿(PbS),电极Ⅱ为含有方铅矿的硫铁矿,当有电解质溶液按如图所示方向流经该装置时,电流表指针偏转.若电极Ⅱ质量不断减少,a处溶液中加入KSCN溶液未出现红色,加入CuSO4溶液未出现黑色沉淀.下列有关说法中正确的是( )| A. | 工业上利用该原理富集铁 | |
| B. | 电极Ⅱ作正极 | |
| C. | 溶液流经该装置后pH增大 | |
| D. | 该装置负极的电极反应为FeS2-15e-+8H2O=Fe3++2SO42-+16H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 过程①中,FeS和O2、H2SO4反应的化学方程式是4FeS+3O2+6H2SO4═2Fe2(SO4)3+6H2O+4S | |
| B. | 过程②中产生的气体会对大气造成污染,可选用氢氧化钠溶液吸收 | |
| C. | 过程③中,需要加入的物质名称是稀硫酸 | |
| D. | 过程④中的实验操作是蒸发浓缩、冷却结晶、过滤、洗涤 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
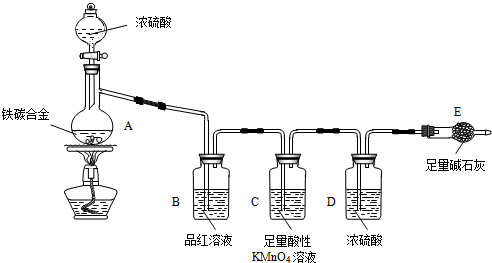
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com