
| A. | 50mL 1mol•L-1 FeCl3溶液 | B. | 25mL 2mol•L-1 CaCl2溶液 | ||
| C. | 50mL 2mol•L-1 KCl溶液 |
分析 根据同一化学式中各微粒的浓度等于物质的物质的量浓度×离子个数,与溶液的体积无关,而50mL 1mol•L-1 MgCl2溶液中Cl-物质的量浓度为2mol/L,据此分析.
解答 解:A、50mL 1mol•L-1 FeCl3溶液中氯离子的浓度为3mol/L,故A错误;
B、25mL 2mol•L-1 CaCl2溶液中氯离子的浓度为4mol/L,故B错误;
C、50mL 2mol•L-1 KCl溶液中氯离子的浓度为2mol/L,故C正确.
故选C.
点评 本题考查物质的量浓度的计算与理解,题目难度不大,注意溶液中溶质离子的浓度与溶液体积无关,只取决于物质电离出的离子的数目多少与溶质的浓度.


科目:高中化学 来源: 题型:选择题
| A. | 摩尔是联系宏观和微观的物理量 | |
| B. | Na的摩尔质量为23g/mol | |
| C. | 非标准状况下气体摩尔体积不可能为22.4 L | |
| D. | 1mol氢的质量为2g |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 弱电解质溶液中至少存在两种共价化合物分子 | |
| B. | 强电解质都是离子化合物,弱电解质都是共价化合物 | |
| C. | NH3属于非电解质,但其水溶液能够导电 | |
| D. | 同位素单质混合在一起一般是纯净物 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向0.1mol•L-1CH3COOH溶液中加入少量CH3COONH4固体,溶液的pH增大 | |
| B. | 一定温度下,将pH=a的氨水溶液稀释10倍后,其pH=b,则a=b+1 | |
| C. | 浓度均为0.1mol•L-1的HCN溶液和NaCN溶液等体积混合(忽略体积变化),溶液中c(HCN)+c(CN-)=0.1mol•L-1 | |
| D. | 室温下,pH=4的NaHSO4溶液中,水电离出的H+浓度为1×10-10mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
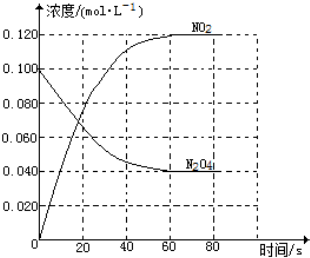 在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度的升高,混合气体的颜色变深.
在容积为1.00L的容器中,通入一定量的N2O4,发生反应N2O4(g)?2NO2(g),随温度的升高,混合气体的颜色变深.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 它可使石蕊试液褪色 | |
| B. | 通入BaCl2溶液中,生成白色沉淀 | |
| C. | SO2通入氢氧化钠与酚酞的混合溶液中红色变浅直至褪去 | |
| D. | 等物质的量的Cl2和SO2通入品红溶液中,品红溶液褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com