
【题目】探究草酸(H2C2O4)性质,进行如下实验。(已知:H2C2O4是弱电解质)
实验 | 装置 | 试剂a | 现象 |
① |
| Ca(OH)2溶液(含酚酞) | 溶液褪色,产生白色沉淀 |
② | 少量NaHCO3溶液 | 产生气泡 | |
③ | 酸性KMnO4溶液 | 紫色溶液褪色 | |
④ | C2H5OH和浓硫酸 | 加热后产生有香味物质 |
由上述实验所得草酸性质所对应的方程式不正确的是( )
A.H2C2O4有酸性:Ca(OH)2+ H2C2O4=CaC2O4↓+2H2O
B.酸性H2C2O4> H2CO3:NaHCO3+ H2C2O4=NaHC2O4+CO2↑+H2O
C.H2C2O4具有还原性:2![]() +5
+5![]() +16H+=2Mn2++10CO2↑+ 8H2O
+16H+=2Mn2++10CO2↑+ 8H2O
D.H2C2O4可发生酯化反应:HOOCCOOH+2C2H5OH![]() C2H5OOCCOOC2H5+2H2O
C2H5OOCCOOC2H5+2H2O
【答案】C
【解析】
草酸(又称乙二酸)为一种二元弱酸,具有酸的通性,因此能发生中和反应;具有还原性;因为乙二酸中含有羧基因此能发生酯化反应,据此解题。
A.H2C2O4为二元弱酸,能与氢氧化钙溶液发生中和反应,生成白色沉淀草酸钙和水,因此氢氧化钙溶液碱性逐渐减弱,溶液红色褪去,A正确;
B.产生气泡证明有CO2 产生,因此可证明酸性H2C2O4>H2CO3,反应方程式为:H2C2O4+2NaHCO3=Na2C2O4+2CO2↑+2H2O,B正确;
C.草酸为弱电解质,故在其参与的离子方程式中要写其化学式,不能用草酸根表示,正确的离子方程式为2![]() +5H2C2O4+6H+=2Mn2++10CO2↑+ 8H2O,C错误;
+5H2C2O4+6H+=2Mn2++10CO2↑+ 8H2O,C错误;
D.草酸(又称乙二酸),结构中含有两个羧基,因此其能发生酯化反应,生成乙二酸二乙醇酯,反应方程式正确,D正确;
故选C。


 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案 名题金卷系列答案
名题金卷系列答案科目:高中化学 来源: 题型:
【题目】Na2S粗品含有杂质,其纯化、含量测定方法如下。回答下列问题:
(1)粗品经水浸、过滤、__________________、洗涤、干燥等操作可以除去不溶性杂质,得到较纯的Na2S固体。
(2)国标中采用如图所示装置测定Na2S样品溶液中Na2CO3的百分含量(实验前,吸收管1、吸收管2、参比管中均装入组成相同的乙醇、丙酮混合溶液,该溶液吸收CO2后,颜色发生改变) 。

(步骤一)标定KOH标准溶液
准确称取w g邻苯二甲酸氢钾(KC8H5O4,摩尔质量为M g/mol)置于锥形瓶中,加入适量蒸馏水、2滴指示剂,用待标定的KOH溶液滴定至终点,消耗v mL KOH溶液。
①标定过程中应该选用的指示剂名称是______,理由是__________;
(已知邻苯二甲酸的电离平衡常数为Ka1=1.1×10-3,Ka2=4.0×10-6)
②KOH溶液的准确浓度为_____mol/L(用含M、v、w的代数式表示)
(步骤二)往三颈烧瓶中先后加入100mL 样品溶液、15 ml过氧化氢溶液(足量),连接好装置,加热并打开抽气装置;
(步骤三)上述反应完成后,从滴液漏斗中慢慢加入足量稀硫酸溶液,充分反应;
(步骤四)用装置6中的KOH标准溶液滴定吸收管1中的溶液至与参比管中溶液相同的颜色,3 min内不变色为终点。
③过氧化氢的作用是______;碱石棉的作用是__________;
④如果抽气速度过快,可能导致测定结果_________(填“偏高”、“偏低”或“无影响”);
⑤若步骤三中出现_______________________(填现象),说明实验失败,必须重新测定。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有 8 种元素的性质、数据如下表所列,它们属于第二或第三周期。
① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
原子半径(10-10m) | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
最高或最低化合价 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
-2 | -3 | -1 | -3 |
回答下列问题:
(1)④的元素名称是_____,⑧的元素符号是_____。②在元素周期表中的位置是(周期、族)_____ 。
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是_____;名称是________; 碱性最强的化合物的电子式是:_________; 属_____化合物(填“离子”或“共价”)。
(3)①的最简单氢化物的电子式为_____, ⑦的最简单氢化物的电子式为_____,结构式为_____。
(4)写出⑦的最高价氧化物对应水化物跟它的氢化物反应的化学方程式:_________________ 。
(5)写出②最高价氧化物对应水化物跟⑤的氢化物水溶液反应的离子方程式:____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素的离子结构示意图为 ,该离子显+1价,则该元素在周期表中的位置是( )
,该离子显+1价,则该元素在周期表中的位置是( )
A. 第5周期零族B. 第6周期第IB族
C. 第5周期第ⅦA族D. 第6周期第IA族
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于反应:![]() ,当其他条件不变,只改变一个反应条件时,将生成SO3的速率的变化填入表格(填写“增大”“减小”或“不变”)。
,当其他条件不变,只改变一个反应条件时,将生成SO3的速率的变化填入表格(填写“增大”“减小”或“不变”)。
编号 | 改变的条件 | 生成SO3的速率 |
① | 升高温度 | _______ |
② | 降低温度 | _______ |
③ | 增大O2的浓度 | _______ |
④ | 使用V2O5作催化剂 | _______ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有四种有机化合物:
甲:![]() 乙:
乙:![]() 丙:
丙:![]() 丁:
丁: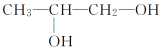
试回答:
(1)甲、乙、丁都含有的官能团的名称是________,四种物质中互为同分异构体的是________(填编号,下同)。
(2)1 mol甲、乙、丁分别与足量Na反应,生成H2最多的是_______________。
(3)丁与醋酸在催化剂作用下发生取代反应生成的酯有__________种。
(4)①写出甲与乙醇发生酯化反应的化学方程式:_____________________。
②写出乙与新制氢氧化铜悬浊液反应的化学方程式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.A是石油裂解气的主要成分,A的产量通常用来衡量一个国家的石油化工水平;
Ⅱ.![]() 。现以A为主要原料合成乙酸乙酯,其合成路线如图所示。
。现以A为主要原料合成乙酸乙酯,其合成路线如图所示。

试回答下列问题:
(1)写出A的结构式___________________________________。
(2)B、D分子中的官能团名称分别是:_________________、________________。
(3)写出下列反应的反应类型:①_________________,②________________,④__________。
(4)写出下列反应的化学方程式:
①_______________________________________;
②_______________________________________;
④_______________________________________。
(5)设计实验区别B和D:______________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铅蓄电池反应原理为:Pb(s)+PbO2(s)+2H2SO4(aq)![]() 2PbSO4(s)+2H2O(l),下列说法正确的是
2PbSO4(s)+2H2O(l),下列说法正确的是
A.放电时,正极附近pH 减小
B.充电时,铅蓄电池的负极连接电源的正极
C.放电时,负极的电极反应式为:Pb-2e-=Pb2+
D.充电时,阴极的电极反应式为:PbSO4+2e-=Pb+![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2(g)+ I2(g)2HI(g)已经达到平衡状态的标志是________(填序号)。
①![]()
②![]()
③![]() 、
、![]() 、
、![]() 不再随时间而改变
不再随时间而改变
④单位时间内生成![]() 的同时生成
的同时生成![]()
⑤单位时间内生成![]() 的同时生成
的同时生成![]()
⑥反应速率![]()
⑦一个![]() 键断裂的同时有两个
键断裂的同时有两个![]() 键断裂
键断裂
⑧温度和体积一定时,容器内压强不再变化
⑨温度和体积一定时,混合气体的颜色不再变化
⑩温度和压强一定时,混合气体的密度不再变化
温度和体积一定时,混合气体的平均相对分子质量不再变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com