
| A、16O和18O |
| B、金刚石、石墨和C60 |
| C、甲烷和乙烷 |
| D、H2O和H2O2 |


 全能练考卷系列答案
全能练考卷系列答案科目:高中化学 来源: 题型:
| A、在该条件下,反应前后的压强之比为6:5.3 |
| B、若反应开始时容器体积为2L,则v(SO3)=0.35mol/(L?min) |
| C、若把“恒温恒压下”改为“恒压绝热条件下”反应,平衡后n(SO3)<1.4mol |
| D、若把“恒温恒压下”改为“恒温恒容下”反应,达平衡时放出热量大于Q kJ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、NaI和NaIO3在一定条件下能反应生成I2 |
| B、I2在反应①中是还原产物,在反应②中是氧化产物 |
| C、两个反应中生成等量的I2时转移电子数相等 |
| D、氧化性:MnO2>IO3->I2>SO42->Mn2+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、乙炔的电子式:H:C:::C:H |
| B、丙烯的结构式:CH3CHCH2 |
| C、醛基的结构简式:-COH |
D、丙烷分子的球棍模型: |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、某醋酸溶液的pH=a,将此溶液稀释1倍后,溶液的pH=b,则a>b |
| B、pH=3的盐酸与pH=11的氨水等体积混合,混合溶液呈酸性 |
| C、等体积等浓度的氢氧化钠与醋酸混合,混合溶液中c(Na+)=c(CH3COO-) |
| D、若1 mLpH=1的盐酸与100 mLNaOH溶液混合后,溶液的pH=7,则NaOH溶液的pH=11 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、稀释溶液,HA电离平衡常数增大 |
| B、升高温度,HA电离程度增大 |
| C、加入NaA固体,平衡朝正反应方向移动 |
| D、加入NaOH固体,溶液pH减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:

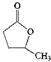
| 溴代试剂(NBS) |
| △ |
 ,请回答
,请回答查看答案和解析>>
科目:高中化学 来源: 题型:
| 800℃ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com