
某小组利用H2C2O4溶液和酸性KMnO4溶液反应来探究“条件对化学反应速率的影响”。实验时,先分别量取两种溶液,然后倒入试管中迅速振荡,混合均匀,开始计时,通过测定褪色所需时间来判断反应的快慢。该小组设计了如下方案:
| 编号 | H2C2O4溶液 | 酸性KMnO4溶液 | 温度/℃ | ||
| 浓度/mol•L-1 | 体积/mL | 浓度/mol•L-1 | 体积/mL | ||
| ① | 0.10 | 2.0 | 0.010 | 4.0 | 25 |
| ② | 0.20 | 2.0 | 0.010 | 4.0 | 25 |
| ③ | 0.20 | 2.0 | 0.010 | 4.0 | 50 |
(1)该反应的离子方程式为 ;
(2)探究温度对化学反应速率影响的实验编号是 (填编号,下同),可探究反应物浓度对化学反应速率影响的实验编号是 ;
(3)实验①测得KMn04溶液的褪色时间为40 s,忽略混合前后溶液体积的微小变化,这段时间内平均反应速率v(KMn04)= mol·L-1·min-1;
(4)已知50℃时c(MnO4-)~反应时间t的变化曲线如图。若保持其他条件不变,请在坐标图中,画出25℃时c(Mn04-)~t的变化曲线示意图。

【答案】(1)16H++5H2C2O4+2MnO4 -=2Mn2++10CO2↑+8H2O (2)②③;①② (3)0.010或1.0×10-2
(4)
【解析】
试题分析:(1)根据反应后H2C2O4转化为CO2逸出,KMnO4转化为MnSO4,利用化合价升降相等写出反应的化学方程式为:2KMnO4+5H2C2O4+3H2SO4=K2SO4+2MnSO4+8H2O+10CO2↑,则离子方程式为16H++5H2C2O4+2MnO4-=2Mn2++10CO2↑+8H2O,故答案为:16H++5H2C2O4+2MnO4 -=2Mn2++10CO2↑+8H2O;
(2)探究温度对化学反应速率影响,必须满足除了温度不同,其他条件完全相同,所以满足此条件的实验编号是:②和③;探究反应物浓度对化学反应速率影响,除了浓度不同,其他条件完全相同的实验编号是①和②,故答案为:②和③; ①和②;
(3)草酸的物质的量为:0.10mol•L-1×0.002L=0.0002mol,高锰酸钾的物质的量为:0.010mol•L-1×0.004L=0.00004mol,草酸和高锰酸钾的物质的量之比为:0.0002mol:0.00004mol=5:1,显然草酸过量,高锰酸钾完全反应,混合后溶液中高锰酸钾的浓度为:(0.010mol/L×0.004L)÷(0.002L+0.004L)= ×0.010mol/L,这段时间内平均反应速率v(KMnO4)=
×0.010mol/L,这段时间内平均反应速率v(KMnO4)= ×0.010mol/L÷40s/60s/min=0.010mol•L-1•min-1,故答案为:0.010或1.0×10-2;
×0.010mol/L÷40s/60s/min=0.010mol•L-1•min-1,故答案为:0.010或1.0×10-2;
(4)25℃时反应速率小于50℃时,所以高锰酸根离子的浓度变化比50℃时小,反应需要的时间大于50℃条件下需要的时间,据此画出25℃时c(MnO4-)~t的变化曲线示意图为:,故答案为:。
考点:考查探究温度、浓度对反应速率的影响、浓度随时间变化的曲线


科目:高中化学 来源: 题型:
下列叙述正确的是( )
|
| A. | Li在氧气中燃烧主要生成Li2O2 |
|
| B. | 将SO2通入BaCl2溶液可生成BaSO3沉淀 |
|
| C. | 将CO2通入次氯酸钙溶液可生成次氯酸 |
|
| D. | 将NH3通入热的CuSO4溶液中能使Cu2+还原成Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:
气体X可能由NH3、Cl2、HBr、CO2中的一种或几种组成,已知X通入AgNO3溶液时产生浅黄色沉淀,该沉淀不溶于稀HNO3,若将X通入澄清石灰水中,无沉淀产生,则有关气体X的成分的下列说法正确的是( )
①一定含有HBr,可能含有CO2 ②一定不含CO2 ③一定不含NH3、Cl2 ④可能含有Cl2、CO2.
|
| A. | 只有① | B. | 只有③ | C. | ①和③ | D. | ②和③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
关于Li、Na、K、Rb、Cs的叙述均正确的一组是
①金属性最强的是铯
②它们的氧化物都只有M2O和M2O2两种形式
③在自然界中均以化合态形式存在
④密度按Li—Cs顺序依次递增
⑤离子半径:Rb+>K+>Na+
A.①②③ B.①③④⑤ C.②④⑤ D.①③⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
A与B在容积为1 L的密闭容器中发生反应:aA(s)+bB(g) cC(g)+dD(g),t1,、t2时刻分别测得部分数据如下表:
cC(g)+dD(g),t1,、t2时刻分别测得部分数据如下表:
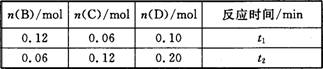
下列说法正确的是
A.0~t1时间段内,平均反应速率v(B)=0.04/t1 mol·(L·min)-1
B.若起始时n(D)=0,则t2时v(D)=0.20/t2 mol·(L·min)-1
C.升高温度,v(B)、vC)、v(D)均增大
D.b:d=6:1
查看答案和解析>>
科目:高中化学 来源: 题型:
下列有关化学用语错误的是
A.硫离子的核外电子排布式:1s22s22p6
C.碳-14的原子组成符号:14 6C
B.碳原子的外围电子轨道表示式: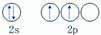
D.Cl-的结构示意图: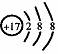
查看答案和解析>>
科目:高中化学 来源: 题型:
下列叙述错误的是
A.离子键没有方向性和饱和性,而共价键有方向性和饱和性
B.离子键的强弱主要决定于离子半径和离子所带电荷数
C.配位键在形成时,由成键双方各提供一个电子形成一对共用电子
D.金属键的实质是金属中的自由电子与金属阳离子形成的一种强烈的相互作用
查看答案和解析>>
科目:高中化学 来源: 题型:
Ⅰ、某一元弱酸HA在水中的电离方程式是:HA H++A-,回答下列问题:
H++A-,回答下列问题:
(1)向溶液中加入适量NaA固体,以上平衡将向________(填“正”、“逆”)反应方向移动,理由是______________________________________________________。
(2)若向溶液中加入适量NaCl溶液,以上平衡将向________(填“正”、“逆”、“不移动”)反应方向移动,溶液中c(A-)将________(填“增大”、“减小”或“不变”,下同),溶液中c(OH-)将________。
Ⅱ、某温度(T℃)时,测得0.01mol/L NaOH溶液的pH为11, 此温度下,将pH=a的NaOH溶液VaL与pH=b的H2SO4溶液VbL混合,通过计算填写以下不同情况时两溶液的体积比:
(1)若所得混合溶液为中性,且a=12,b=2,则Va∶Vb=________。
(2)若所得混合溶液为中性,且a+b=12,则Va∶Vb=________。
(3)若所得混合溶液的pH=10,且a=12,b=2,则Va∶Vb=__________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com