
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案科目:高中化学 来源: 题型:阅读理解
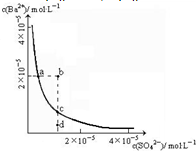 BaSO4在水中存在沉淀溶解平衡BaSO4(s)═Ba2+(aq)+SO42-(aq),溶度积常数Ksp=c(Ba2+)?c(SO42-).
BaSO4在水中存在沉淀溶解平衡BaSO4(s)═Ba2+(aq)+SO42-(aq),溶度积常数Ksp=c(Ba2+)?c(SO42-).查看答案和解析>>
科目:高中化学 来源: 题型:
A.NH3·H2O为1 mol ,溶质质量为
B. ![]() 为1 mol ,溶质质量为
为1 mol ,溶质质量为
C.溶解状态的NH3分子为1 mol,溶质质量为
D.氨水中NH3、NH3·H2O、![]() 三种微粒总的物质的量为1 mol
三种微粒总的物质的量为1 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
A.任何气体单质在标准状况下体积为
B.NA个C2H2 分子中含有非极性共价键的数目为NA个
C
D.在
查看答案和解析>>
科目:高中化学 来源:2015届广东省高一下学期期末考试化学试卷(解析版) 题型:选择题
在1 L 1 mol.L-1纯碱溶液中逐滴加入200mL 3.5 mol/L的硫酸,完全反应后生成标准状况下的CO2是 ( )
A.0L B.8.96L C.15.68 L D.26.88L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com