
 ,
,分析 苯的二氯代物于四氯代物有相似的结构,在催化条件下,苯与液溴发生取代反应生成溴苯,因溴易溶于苯,所得溴苯常显褐色,可用氢氧化钠溶液除去溴,以此解答该题.
解答 解:(1)苯的2氯取代有邻、间、对3种,则4氯取代也有3种,故答案为:3;3;
(2)在催化条件下,苯与液溴发生取代反应生成溴苯,方程式为 ,
,
故答案为: ;
;
(3)因溴易溶于苯,所得溴苯常显褐色,可用氢氧化钠溶液除去溴,反应的方程式为Br2+2NaOH=NaBr+NaBrO+H2O,除去颜色的简单步骤是向产物中加入稀氢氧化钠溶液洗涤,除去溴,然后再通过分液漏斗进行分液操作,除去溴化钠,
故答案为:产物中溶有未反应的溴;向产物中加入稀氢氧化钠溶液洗涤,除去溴,然后再通过分液漏斗进行分液操作,除去溴化钠;Br2+2NaOH=NaBr+NaBrO+H2O.
点评 本题综合考查苯的性质,为高频考点,侧重于学生的分析能力的考查,注意把握苯的结构、性质,难度不大.


 名校通行证有效作业系列答案
名校通行证有效作业系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
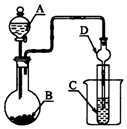
| A. | 若A为浓硫酸,B为Na2SO3固体,C中盛石蕊溶液,则C中溶液先变红后褪色 | |
| B. | 若A为醋酸溶液,B为贝壳,C中盛过量澄清石灰水,则C中溶液变浑浊 | |
| C. | 若A为浓盐酸,B为MnO2,C中盛品红溶液,则C中溶液不褪色 | |
| D. | 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中产生白色沉淀 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 氯化亚砜用于医药、农药、染料工业及有机合成工业,常作氯化剂,制锂氯化亚砜(Li/SOCl2)电池.工业上用SO2、SCl2与Cl2反应合成SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g).
氯化亚砜用于医药、农药、染料工业及有机合成工业,常作氯化剂,制锂氯化亚砜(Li/SOCl2)电池.工业上用SO2、SCl2与Cl2反应合成SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g).| t/min | 0 | 1 | 2 | 3 | 4 | 5 | |
| I | p | 6.0p0 | 6.7p0 | 6.1p0 | 5.4p0 | 5.0p0 | 5.0p0 |
| II | p | 6.0p0 | 7.0p0 | 5.3p0 | 5.0p0 | 5.0p0 | 5.0p0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 夏天打开啤酒盖,喷出大量泡沫 | |
| B. | 工业上合成氨气时采用高温利于氨气的合成 | |
| C. | 在HI的分解实验达到平衡后加压颜色变深 | |
| D. | 锌和稀硫酸制备氢气时滴入少量硫酸铜可以加快速率 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 足量铁在1molCl2中燃烧时转移电子数为2NA | |
| B. | 2L0.1mol•L-1氯化钾溶液中阴离子所带电荷数为NA | |
| C. | 1L0.1mol•L-1的Na2CO3溶液中HCO3-和CO32-离子数之和为0.1NA | |
| D. | 标准状况下,体积各为2.24L的HCl和NH3混合气体中含有的共价键数为0.25NA |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com