
分析 (1)①硫酸的质量分数等于硫酸溶质的质量除以混合溶液的质量;
②氢离子的物质的量与氢氧根的物质的量相等;
(2)①质量增重为O元素;
②O元素的物质的量等于氧化铜的物质的量;
(3)103.2g混合物含铜1.35mol,根据电子得失守恒计算一氧化氮的物质的量;
(4)①固体中含铜0.027mol,氧化铜0.0042mol.设加入的混酸中H2SO4与HNO3的物质的量均为amol,恰好完全反应后溶液中溶质为CuSO4和Cu(NO3)2,根据电荷守恒解题;
②固体中含铜0.027mol,氧化铜0.0042mol,根据铜元素守恒计算理论产量.
解答 解:(1)①硫酸的质量分数:$\frac{3×0.005×98}{5×1.180+1×1.400}$=20%,故答案为:20%;
②质量为7.3g的混酸中含有硫酸0.015mol、硝酸0.015mol,共0.045molH+.则1g混酸中含有H+为6.164×10-3mol,中和时需要NaOH溶液的体积是12.33mL,故答案为:12.33;
(2)①设铜屑有100g,则含铜99.84g,灼烧后的质量为103.2g,则氧元素的质量为3.36g.氧元素的质量分数为$\frac{3.36}{103.2}$=0.033,故答案为:0.033;
②若混合物为103.2g,则含氧化铜的物质的量为$\frac{3.36}{16}$=0.21mol,含铜$\frac{103.2-0.21×80}{64}$=1.35mol,铜与氧化铜的物质的量之比为45:7,故答案为:45:7;
(3)103.2g混合物含铜1.35mol,2.064g固体中含铜0.027mol.根据电子得失守恒可知一氧化氮的物质的量为$\frac{0.027×2}{3}$=0.018mol,其体积为0.018×22.4×1000=403.2mL,故答案为:403.2mL;
(4)①固体中含铜0.027mol,氧化铜0.0042mol.设加入的混酸中H2SO4与HNO3的物质的量均为amol,恰好完全反应后溶液中溶质为CuSO4和Cu(NO3)2,则有电荷守恒:
2×(0.027+0.0042)=2a+a-0.018;
解得a=0.0268mol.
溶液中CuSO4的物质的量为0.0268mol,故答案为:0.0268 mol;
②胆矾的理论产量为(0.027+0.0042)×250=7.8g,产率为$\frac{6.4}{7.8}$=82%,故答案为:82%.
点评 本题考查制备实验方案的设计,主要考查物质含量的计算,侧重于实验原理的考查,注意用守恒法解题,题目难度中等.


科目:高中化学 来源: 题型:选择题
| A. | 难溶于水 | B. | 易挥发,有毒性 | ||
| C. | 苯分子中含有碳碳双键 | D. | 属于烃类化合物 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2SO2+O2=2SO3△H=-196.6kJ•mol-1 | |
| B. | N2(g)+2O2(g)=2NO2(g)△H=+67.7kJ•mol-1 | |
| C. | C(s)+O2(g)=CO2(g)△H=+393.51kJ•mol-1 | |
| D. | H2O(l)=H2(g)+$\frac{1}{2}$O2(g)△H=+285.8kJ•mol-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题


查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 实验步骤 | 实验预期现象及结论 |
| 步骤一:取少量的FeSO4 固体于试管中,加入一定量水溶解 | |
| 步骤二: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
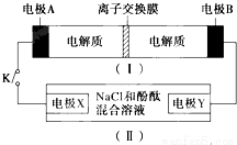
| A. | 闭合K时,X的电极反应式为:2H++2e-═H2↑ | |
| B. | 闭合K时,A电极反应式为:NiO2+2e-+2H+═Ni(OH)2 | |
| C. | 给装置(Ⅰ)充电时,B极参与反应的物质被氧化 | |
| D. | 给装置(Ⅰ)充电时,OH-通过阴离子交换膜,移向A电极 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com