
【题目】某同学设计如图装置进行乙醇氧化反应的探究实验,有关说法不正确的是()
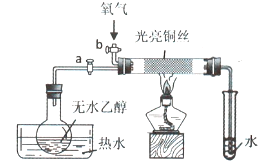
A.热水的作用是促使乙醇挥发,为硬质玻璃管内提供乙醇蒸汽
B.通入乙醇蒸汽反应的过程中,撤离酒精灯后反应仍能进行
C.在硬质玻璃管内发生的主反应为:![]()
D.实验结束时,先停止加热,再关闭活塞a、b,最后将导管移出水面
 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案科目:高中化学 来源: 题型:
【题目】已知反应 CO(g) + H2O(g) ![]() CO2(g) + H2(g) ΔH<0。在恒温恒压密闭容器中,反应达到平衡。下列叙述正确的是( )。
CO2(g) + H2(g) ΔH<0。在恒温恒压密闭容器中,反应达到平衡。下列叙述正确的是( )。
A.充入一定量的氙气,n(H2)不变B.增大压强,n(CO2)减小
C.更换高效催化剂,CO 转化率增大D.降低温度,平衡常数 K 减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一容积不变的密闭容器中加入![]() 、
、![]() 和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如图一所示。图二为
和一定量的B三种气体。一定条件下发生反应,各物质浓度随时间变化如图一所示。图二为![]() 时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知只有
时刻后改变反应条件,平衡体系中反应速率随时间变化的情况,且四个阶段都各改变一种不同的条件。已知只有![]() 阶段为使用催化剂;图一中
阶段为使用催化剂;图一中![]() 阶段
阶段![]() 未画出。
未画出。
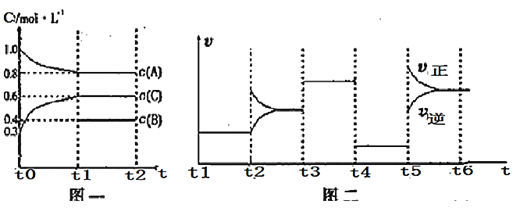
下列说法不正确的是
A.此温度下该反应的化学方程式![]()
![]()
B.![]() 阶段改变的条件为减小压强
阶段改变的条件为减小压强
C.B的起始物质的量为1mol
D.在相同条件下,若起始时容器中加入![]() 、
、![]() 和
和![]() ,要达到
,要达到![]() 时刻同样的平衡,a、b、c要满足的条件为
时刻同样的平衡,a、b、c要满足的条件为![]() 和
和 ![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】加热聚丙烯废塑料可以得到炭、氢气、甲烷、乙烯、丙烯、苯和甲苯。用如图所示装置探究废塑料的再利用。下列叙述中不正确的是( )

A.装置乙的试管中可收集到芳香烃B.装置丙中的试剂可吸收烯烃
C.最后收集的气体可作燃料D.该实验是聚丙烯发生加聚反应的实验
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知以下的热化学反应方程式:
Fe2O3(s)+![]() CO(g)=2/3Fe3O4(s)+
CO(g)=2/3Fe3O4(s)+![]() CO2(g) ΔH=-15.73kJ/mol
CO2(g) ΔH=-15.73kJ/mol
Fe3O4(s)+CO(g)=3FeO(s)+CO2(g) ΔH=+640.4kJ/mol
Fe2O3(s)+3CO(g)=2Fe(s)+3CO2(g) ΔH=-24.8kJ/mol
则56gCO气体还原足量FeO固体得到Fe固体和CO2气体时对应的ΔH约为( )
A.-327kJ/molB.+327kJ/mol
C.+436kJ/molD.-436kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从海水中可以获得淡水、食盐,并可提取镁和溴等物质。
(1)从海水中提取镁的流程如图所示:
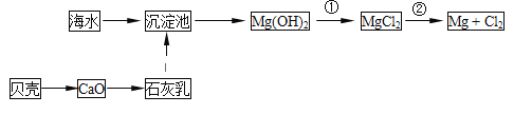
反应①的离子方程式为__;
反应②的化学方程式为__;
(2)海水提取溴流程:
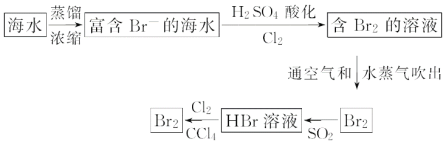
①该流程中涉及发生反应的离子方程式: __; ___;
②该流程中溴元素被氧化又被还原又被氧化的目的是:___;
③从最终溴的四氯化碳溶液中得到液溴,应采取的操作是__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
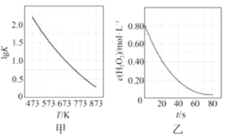
A.3 mol H2与1 mol N2混合反应生成NH3,转移电子的数目等于6×6.02×1023
B.反应4Fe(s)+3O2(g)=2Fe2O3(s)常温下可自发进行,该反应为吸热反应
C.图甲是CO(g)+H2O(g)=CO2(g)+H2(g)的平衡常数与反应温度的关系曲线,说明该反应的ΔH<0
D.图乙是室温下H2O2催化分解放出氧气的反应中c(H2O2 )随反应时间变化的曲线,说明随着反应的进行H2O2分解速率逐渐增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】周期表前四周期的元素a、b、c、d、e,原子序数依次增大。a的核外电子总数与其周期数相同;基态b原子的核外电子占据3个能级,且最高能级轨道为半充满状态;c的最外层电子数是内层电子数的3倍;d的原子序数是c的两倍;基态e原子3d轨道上有4个单电子。
回答下列问题:
(1)b、c、d电负性最大的是___(填元素符号)。
(2)b单质分子中σ键与π键的个数比为___。
(3)a与c可形成两种二元化合物分子,两种物质可以任意比互溶。其中一种不稳定,可分解产生c的单质,该化合物分子中的c原子的杂化方式为___;这两种物质的互溶物中,存在的化学键有___(填序号)。
①极性共价键 ②非极性共价键 ③离子键 ④金属键 ⑤氢键 ⑥范德华力
(4)这些元素形成的含氧酸中,分子内中心原子的价层电子对数为4的酸是___(填化学式,下同);酸根呈正三角形结构的酸是___,试从两者结构特点判断该酸分子与酸根离子的稳定性:酸分子___酸根离子(填“>”或“<”)。
(5)元素e在周期表中的位置是___区;e的一种常见氯化物中的化学键具有明显的共价性,蒸汽状态下以双聚分子存在,结构式为![]() ,请补写e的元素符号并用“→”表示出其中的配位键___。
,请补写e的元素符号并用“→”表示出其中的配位键___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用CO与H2反应合成优质燃料甲醇。
(1)已知燃烧6.4g甲醇放出145.16kJ热量,请写出表示甲醇燃烧热的热化学方程式:_______。
(2)甲醇燃料电池具有能量密度大,对环境污染小等优点,有一种甲醇碱性燃料电池装置如图所示:

①甲醇应由______(选填“a”或“b”)极通入,其电极反应式为___________;
②当电路中通过1.2mol电子时,a极室n(OH-)减少____________mol;
(3)已知:CO(g)+2H2(g) ![]() CH3OH(g) ΔH=-129.0 kJ·mol-1,在一恒容密闭容器中,按照a mol CO和2a mol H2投料,测得CO在不同温度下的平衡转化率与压强关系如图所示,则下列说法正确的是____。
CH3OH(g) ΔH=-129.0 kJ·mol-1,在一恒容密闭容器中,按照a mol CO和2a mol H2投料,测得CO在不同温度下的平衡转化率与压强关系如图所示,则下列说法正确的是____。

a.温度:T1>T2>T3
b.平均摩尔质量:M(a)>M(c)、M(b)>M(d)
c.正反应速率:v(a)<v(c)、v(b)>v(d)
d.平衡常数:K(a)<K(c)、K(b)=K(d)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com