
 有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色黏稠液体,易溶于水.为研究A的组成与结构,进行了如下实验:
有机物A可由葡萄糖发酵得到,也可从酸牛奶中提取.纯净的A为无色黏稠液体,易溶于水.为研究A的组成与结构,进行了如下实验: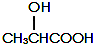 .A与浓H2SO4混合,在一定条件下反应生成六元环状物B,B的结构简式
.A与浓H2SO4混合,在一定条件下反应生成六元环状物B,B的结构简式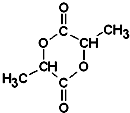 .
. 分析 (1)同温同压下,气体的密度之比等于相对分子质量之比,据此计算;
(2)浓硫酸增重7.2g为水的质量,碱石灰增重17.6g为二氧化碳质量,计算有机物、水、二氧化碳物质的量,进而计算n(H)、n(C),根据质量守恒确定是否含有O元素,根据元素守恒来确定有机物的分子式;
(3)能与足量的NaHCO3粉末反应,说明含有-COOH,根据生成的二氧化碳的物质的量确定-COOH数目,能与钠反应生成氢气,结合生成氢气的物质的量确定是否含有-OH及羟基数目;
(4)核磁共振氢谱图中有几个峰值则含有几种类型的等效氢原子,峰面积之比等于氢原子的数目之比;
(5)由A的分子式、含有的官能团及核磁共振氢谱书写其结构简式,进而确定B的结构简式.
解答 解:(1)由其密度是相同条件下H2的45倍,可知A的相对分子质量为45×2=90,
故答案为:90;
(2)由题意可推知:n(A)=$\frac{9.0g}{90g/mol}$=0.1 mol,n(C)=n(CO2)=$\frac{13.2g}{44g/mol}$=0.3 mol,n(H)=2n(H2O)=2×$\frac{5.4g}{18g/mol}$=0.6 mol,
n(O)=$\frac{9.0g-(0.3×12)g-(0.6×1)g}{16g/mol}$=0.3 mol,
所以A的分子式为C3H6O3,
故答案为:C3H6O3;
(3)0.1 mol A与NaHCO3反应放出0.1 mol CO2,则说A中应含有一个羧基,而与足量金属钠反应则生成0.1 mol H2,说明A中还含有一个羟基,
故答案为:-COOH、-OH;
(4)核磁共振氢谱中有4个吸收峰,面积之比为1:1:1:3,可知A中应含有4种不同环境的氢原子,
故答案为:4;
(5)综上所述,A的结构简式: ,可推知B的结构简式:
,可推知B的结构简式: ,
,
故答案为: ;
; .
.
点评 本题考查有机物推断及有机物结构和性质,侧重考查学生分析推断及计算能力,注意碳酸氢钠只和羧基反应,但醇羟基和羧基都与钠反应,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 利用丁达尔效应可以区分溶液和胶体 | |
| B. | 加热饱和FeCl3溶液可制取Fe(OH)3胶体 | |
| C. | 利用焰色反应可以鉴别NaCl、KNO3、Na2SO4 | |
| D. | 用Ca(OH)2溶液可以区分Na2CO3和NaHCO3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将少量Na2O2固体加入到Ca(HCO3)2溶液中,溶液中有反应:Ca2++OH-+HCO3-═CaCO3↓+H2O | |
| B. | 铁和稀盐酸反应:2Fe+6H+═3H2↑+2Fe3+ | |
| C. | 在氢氧化钡溶液中加入少量小苏打:Ba2++2OH-+2HCO3-═BaCO3↓+CO32-+2H2O | |
| D. | 硝酸铝溶液中加入过量氨水:Al3++4NH3•H2O═AlO2-+4NH4++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Fe2+、Na+、SO42-、H2O2 | B. | SO32-、MnO4-、H+、K+ | ||
| C. | Pb2+、K+、SO42-、Cl- | D. | Na+、SO32-、K+、SO42- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 铁跟FeCl3溶液反应:Fe+Fe3+═2Fe2+ | |
| B. | 金属铝溶于氢氧化钠溶液:Al+2OH-═AlO2-+H2↑ | |
| C. | FeCl2溶液跟Cl2反应:Fe2++Cl2═Fe3++2Cl- | |
| D. | Fe(OH)3跟盐酸反应:Fe(OH)3+3H+═Fe3++3H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向苏打溶液中滴加少量的稀盐酸:CO32-+2H+═H2O+CO2↑ | |
| B. | 向MgCl2溶液中加入一小块钠:2Na+2H2O═2Na++2OH-+H2↑ | |
| C. | 向AlCl3溶液中加入过量的氨水:Al3++3NH3•H2O═Al(OH)3↓+3NH4+ | |
| D. | 用FeCl3溶液腐蚀印刷电路板上铜箔:Fe3++Cu═Fe2++Cu |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com