
| A. | 0.1 mol•L-1 NH4NO3溶液中:c(NH4+)>c(NO3-)>c(H+)>c(OH-) | |
| B. | 溶有等物质的量NaClO、NaHCO3的溶液中:c(HClO)+c(ClO-)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| C. | 向10 mL 0.2 mol•L-1 NaCl溶液中滴入2 mL 0.1 mol•L-1 AgNO3溶液,溶液中离子浓度大小关系:c(Na+)>c(NO3-)=c(Cl-)>c(Ag+) | |
| D. | 常温下pH=2的醋酸与pH=12的烧碱溶液等体积混合:c(Na+)>c(CH3COO-)>c(OH-)>c(H+) |
分析 A.铵根离子水解显酸性,铵根离子浓度小于硝酸根离子浓度;
B.等物质的量NaClO、NaHCO3的溶液,遵循物料守恒;
C.硝酸银不足,完全反应,且钠离子、硝酸根离子浓度不变;
D.pH=2的醋酸,醋酸浓度大于0.01mol/L,pH=12的烧碱,NaOH浓度为0.01mol/L,等体积混合时醋酸过量,溶液显酸性.
解答 解:A.铵根离子水解显酸性,铵根离子浓度小于硝酸根离子浓度,则离子浓度为c(NO3-)>c(NH4+)>c(H+)>c(OH-),故A错误;
B.等物质的量NaClO、NaHCO3的溶液,遵循物料守恒,则c(HClO)+c(ClO-)=c(CO32-)+c(HCO3-)+c(H2CO3)=c(Na+),故B正确;
C.硝酸银不足,完全反应,且钠离子、硝酸根离子浓度不变,则离子浓度大小为c(Na+)=c(NO3-)>c(Cl-)>c(Ag+),故C错误;
D.pH=2的醋酸,醋酸浓度大于0.01mol/L,pH=12的烧碱,NaOH浓度为0.01mol/L,等体积混合时醋酸过量,溶液显酸性,则离子浓度为c(CH3COO-)>(Na+)>c(H+)>c(OH-),故D错误;
故选B.
点评 本题考查离子浓度大小的比较,为高频考点,把握盐类水解、沉淀沉淀、pH的计算为解答的关键,侧重分析与应用能力的考查,注意物料守恒的应用,题目难度不大.


科目:高中化学 来源: 题型:填空题
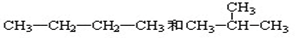

查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
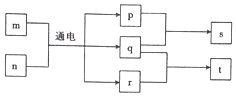 短周期元素W、X、Y、Z的原子序数依次增大,且Y、Z位于同一周期.m、n、s是由这些元素组成的二元化合物,p、q分别是W、Z两元素对应的单质,0.001mol•L-1s溶液的pH为3,t是混合溶液,且该溶液具有漂白性.上述物质的转化关系如图所示.下列说法正确的是( )
短周期元素W、X、Y、Z的原子序数依次增大,且Y、Z位于同一周期.m、n、s是由这些元素组成的二元化合物,p、q分别是W、Z两元素对应的单质,0.001mol•L-1s溶液的pH为3,t是混合溶液,且该溶液具有漂白性.上述物质的转化关系如图所示.下列说法正确的是( )| A. | 元素Y分别与W、X、Z形成的化合物中一定含有离子键 | |
| B. | 离子半径:X<Y<Z | |
| C. | 由元素W、X组成的化合物中一定只含极性键 | |
| D. | s为强酸,r为弱碱 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向NaOH溶液中通SO2至pH=7:c(Na+)═c(HSO3-)+2c(SO32-) | |
| B. | 向NH4Cl溶液中加入等浓度等体积的NH3•H2O后,所得溶液呈碱性,则:c(NH4+)<c(NH3•H2O) | |
| C. | 向NH4HSO4加入等浓度等体积的NaOH溶液后后:c(NH4+)+c(NH3•H2O)═c(Na+) | |
| D. | 向CH3COOH溶液中加入少量CH3COONa晶体:$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)}$ 增大 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 水果存贮库常放置浸泡高锰酸钾溶液的硅藻土,可以延长水果保存期 | |
| B. | 甲醛可使蛋白质发生变性,所以福尔马林可用于杀菌消毒 | |
| C. | 用加入足量氢氧化钠溶液共热的方法可以区分地沟油与矿物油 | |
| D. | 切开的苹果空气中变黄与漂白过的纸张久置变黄原理相似 |
查看答案和解析>>
科目:高中化学 来源: 题型:计算题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com