
| 选项 | 操作 | 现象 | 解释或理论 |
| A | 把铁片投入浓硫酸 | 无明显变化 | 常温下铁不与浓硫酸反应 |
| B | 将浓硫酸滴到白纸上 | 白纸变黑 | 浓硫酸具有强氧化性,导致纸中的纤维素碳化 |
| C | 把二氧化硫通入溴水 | 溴水褪色 | 说明二氧化硫具有漂白性 |
| D | 用湿润的红色石蕊试纸检验某气体 | 试纸变蓝 | 该气体是氨气 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.常温下浓硫酸与铁发生钝化反应;
B.浓硫酸表现脱水性;
C.二氧化硫和溴发生氧化还原反应;
D.氨气的水溶液呈碱性.
解答 解:A.铁片投入浓硫酸,没有明显变化,是由于铁与浓硫酸发生钝化反应,在表面生成一层致密的氧化物膜而阻碍反应的继续进行,并不是不反应,故A错误;
B.浓硫酸具有脱水性,使纤维素碳化,故B错误;
C.二氧化硫与溴水发生氧化还原反应,不是表面的漂白性,故C错误;
D.试纸变蓝,说明气体水溶液呈碱性,溶液呈碱性的气体只有氨气,故D正确.
故选D.
点评 本题考查较为综合,多角度考查元素化合物知识,为高频考点,侧重于学习的分析能力和评价能力的考查,注意把握物质的性质的异同,难度不大.


科目:高中化学 来源: 题型:选择题
| 元素 | I1 | I2 | I3 | I4 |
| X | 500 | 4600 | 6900 | 9500 |
| Y | 580 | 1800 | 2700 | 11600 |
| A. | 元素X的常见化合价是+1价 | |
| B. | 若元素Y处于第3周期,它可与冷水剧烈反应 | |
| C. | 元素X与氯形成化合物时,化学式可能是XCl | |
| D. | 元素Y是ⅢA族的元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+,Na+,NO3-,Cl- | B. | K+,Ba2+,Cl-,NO3- | ||
| C. | Na+,HCO3-,CO32-,K+ | D. | Na+,Cl-,K+,MnO4- |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
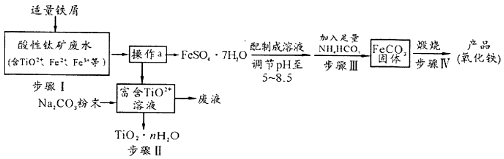
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 鉴别苯与四氯化碳:碘水 | |
| B. | 鉴别甲烷与乙烯:酸性高锰酸钾溶液 | |
| C. | 鉴别 与CH≡CH:溴水 与CH≡CH:溴水 | |
| D. | 鉴别NaCl与CH3CH2Cl:硝酸银溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 离子组 | 加入试剂 | 加入试剂后发生反应 | |
| A | K+、Fe2+、I- | 少量的酸性KMnO4溶液 | 5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O |
| B | Fe3+、I-、SO42- | NaOH溶液 | Fe3++3OH-═Fe(OH)3↓ |
| C | Ba2+、HCO3-、Cl- | NaOH溶液 | HCO3-+OH-═CO32-+H2O |
| D | Al3+、Cl-、NO3- | 过量浓氨水 | Al3++3NH3•H2O═Al(OH)3↓+3NH4+ |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
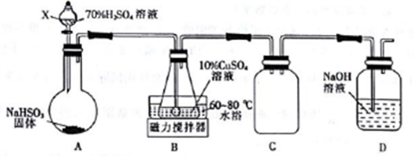
| 实验操作 | 预期现象及结论 |
| 取上述反应后的混合溶液于试管 A中,滴加稀硫酸 | 若有气泡产生,则①II(填“I”“II”或“III”,下同)成立,若没有气泡产生,则②I或III成立 |
| 另取上述反应后的混合溶液于试管B中,滴加几滴淀粉KI溶液,充分振荡 | ③溶液变为蓝色,则III成立 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
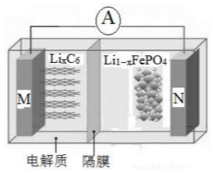 磷酸铁锂电池具有高效率输出、可快速充电、对环境无污染等优点,其工作原理如图.M电极是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为LixC6+Li1-xFeO4$?_{充电}^{放电}$LiFePO4+6C.下列说法正确的是( )
磷酸铁锂电池具有高效率输出、可快速充电、对环境无污染等优点,其工作原理如图.M电极是金属锂和碳的复合材料(碳作为金属锂的载体),电解质为一种能传导Li+的高分子材料,隔膜只允许Li+通过,电池反应式为LixC6+Li1-xFeO4$?_{充电}^{放电}$LiFePO4+6C.下列说法正确的是( )| A. | 放电时Li+从右边移向左边 | |
| B. | 放电时M是负极,电极反应式为:C6x--xe-═6C | |
| C. | 充电时电路中通过0.5mol电子,消耗36gC | |
| D. | 充电时N极连接电源的正极,电极反应式为:LiFePO4-xe-═Li1-xFeO4+xLi+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 7 g乙烯和丙烯混合气体中的氢原子数目 | |
| B. | 0.5 mol Fe溶于过量HNO3溶液中,转移的电子数目 | |
| C. | 2.5 L 0.4 mol/L 的 Na2CO3 溶液中 CO32-数目 | |
| D. | 标准状况下,5.6 L CCl4含有的共价键数目 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com