
【题目】在298K、1.01×105Pa下,将22gCO2通入750mL1mol·L-1NaOH溶液中充分反应,测得反应放出xkJ的热量。已知在该条件下,1molCO2通入1L2mol·L-1NaOH溶液中充分反应放出ykJ的热量,则CO2与NaOH溶液反应生成NaHCO3的热化学方程式正确的是( )
A.CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(2y-x) kJ·mol-1
B.CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(2x-y) kJ·mol-1
C.CO2(g)+NaOH(aq)=NaHCO3(aq) ΔH=-(4x-y) kJ·mol-1
D.CO2(g)+NaOH(l)=NaHCO3(l) ΔH=-(8x-2y) kJ·mol-1
【答案】C
【解析】
根据题意可知,22gCO2通入1molL-1NaOH溶液750mL中充分反应,测得反应放出xkJ的热量,写出热化学反应方程式,再利用1mol CO2通入2molL-1NaOH溶液1L中充分反应放出y kJ的热量写出热化学反应方程式,最后利用盖斯定律来书写CO2与NaOH溶液反应生成NaHCO3的热化学方程式.
22gCO2通入![]() 溶液750mL中充分反应,
溶液750mL中充分反应,![]() ,
,![]() 该反应既生成碳酸钠又生成碳酸氢钠,方程
该反应既生成碳酸钠又生成碳酸氢钠,方程![]() 式为,由0.5molCO2反应放出热量为xkJ,则2molCO2反应放出热量为4xkJ,即热化学反应方程式为
式为,由0.5molCO2反应放出热量为xkJ,则2molCO2反应放出热量为4xkJ,即热化学反应方程式为 ![]()
![]() ①,又1molCO2通入溶液1L
①,又1molCO2通入溶液1L![]() 中充分反应放出ykJ的热量,则热化学方程式为
中充分反应放出ykJ的热量,则热化学方程式为 ![]()
![]() ②,
②,
由盖斯定律可知,①②可得,![]()
![]() 。
。
故选:C。


科目:高中化学 来源: 题型:
【题目】汽车尾气是城市的主要空气污染物,研究控制汽车尾气成为保护环境的首要任务。
(1)汽车内燃机工作时发生反应:N2(g) + O2(g)![]() 2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向5L密闭容器中充入6.5 molN2和7.5 molO2,在5 min时反应达到平衡状态,此时容器中NO的物质的量是5 mol。
2NO(g),是导致汽车尾气中含有NO的原因之一。T ℃时,向5L密闭容器中充入6.5 molN2和7.5 molO2,在5 min时反应达到平衡状态,此时容器中NO的物质的量是5 mol。
① 5 min内该反应的平均速率υ(NO) = ;在T ℃时,该反应的平衡常数K = 。
② 反应开始至达到平衡的过程中,容器中下列各项发生变化的是 (填序号)。
a. 混合气体的密度 b. 混合气体的压强
c. 正反应速率 d. 单位时间内,N2和NO的消耗量之比
(2)H2或CO可以催化还原NO以达到消除污染的目的。
已知:N2(g) + O2(g) = 2NO(g) H=" +180.5" kJ·mol-1
2H2(g) + O2(g) = 2H2O(l) H= -571.6 kJ·mol-1
则H2(g)与NO(g)反应生成N2(g)和H2O(l)的热化学方程式是 。
(3)当质量一定时,增大固体催化剂的表面积可提高化学反应速率。下图表示在其他条件不变时,反应:2NO(g) + 2CO(g)![]() 2CO2(g) + N2(g) 中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
2CO2(g) + N2(g) 中NO的浓度[c(NO)]随温度(T)、催化剂表面积(S)和时间(t)的变化曲线。
① 该反应的H 0 (填“>”或“<”)。
② 若催化剂的表面积S1>S2 ,在下图中画出c(NO) 在T1、S2 条件下达到平衡过程中的变化曲线。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定条件下,已达平衡的可逆反应:2A(g)+B(g)![]() 2C(g),下列说法中正确的是 ( )
2C(g),下列说法中正确的是 ( )
A. 平衡时,此反应的平衡常数K与各物质的浓度有如下关系:K=![]()
B. 改变条件后,该反应的平衡常数K一定不变
C. 如果改变压强并加入催化剂,平衡常数会随之变化
D. 若平衡时增加A和B的浓度,则平衡常数会减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验、现象及相关结论均正确的是
A | B | C | D | |
实验 |
|
|
|
|
现象 | 品红褪色 | 最后试管有浅黄色沉淀 | 最后一滴溶液使酚酞由无色变为粉红色,且30s不复原 | 出现白色沉淀 |
结论 | SO2 有强强氧化性 | 有机物中含有溴原子 | 滴定达终点 | Ksp(AgCl)>Ksp(AgI) |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)汽车尾气是城市空气污染的一个重要因素,一种CO分析仪的传感器可测定汽车尾气是否符合排放标准,该分析仪的工作原理类似燃料电池,其中电解质是氧化钇(Y2O3)和氧化锆(ZrO2)晶体,在高温熔融状态下能传导O2-(过程中无气体产生),则负极的反应式为___。
(2)以上述电池为电源,通过导线连接成图一电解池。
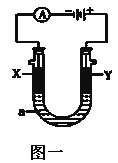
①若X、Y为石墨,a为2L0.1mol/LKCl溶液,写出电解总反应的离子方程式___。
②若X、Y分别为铜、银,a为1L0.2mol/LAgNO3溶液,写出Y电极反应式___。
(3)室温时,按上述(2)①电解一段时间后,取25mL上述电解后的溶液,滴加0.4mol/L醋酸得到图二(不考虑能量损失和气体溶于水,溶液体积变化忽略不计)。

①结合图二计算,上述电解过程中消耗一氧化碳的质量为___g。
②若图二的B点pH=7,则滴定终点在___区间(填“AB”、“BC”或“CD”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是金属镁和卤素单质(X2)反应的能量变化示意图.下列说法正确的是( )

A. 由MgCl2制取Mg是放热过程
B. 热稳定性:MgI2>MgBr2>MgCl2>MgF2
C. 常温下氧化性:F2<Cl2<Br2<I2
D. 由图可知此温度下MgBr2(s)与Cl2(g)反应的热化学方程式为:MgBr2(s) + Cl2(g) ═ MgCl2(s) + Br2(g) △H = -117kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向容积固定不变的密闭容器里充入a mol NO2,发生如下反应:2NO2(g)![]() N2O4(g),达到平衡后,再向该容器内充入a mol NO2,达平衡后与原平衡比较错误的是
N2O4(g),达到平衡后,再向该容器内充入a mol NO2,达平衡后与原平衡比较错误的是
A.平均相对分子质量增大 B.NO2的转化率提高
C.压强为原来的2倍 D.颜色变深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向NaOH溶液中缓慢通入![]() 气体,溶液中
气体,溶液中![]() 的物质的量与通入
的物质的量与通入![]() 物质的量的关系图如下。下列关于图中a、b两点溶液的说法错误的是( )
物质的量的关系图如下。下列关于图中a、b两点溶液的说法错误的是( )

A.a、b溶液与同浓度盐酸完全反应时,消耗盐酸的体积相同
B.a溶液中水的电离程度与b溶液中水的电离程度相同
C.a、b两溶液都满足:![]()
D.将a、b两点混合后溶液满足:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海洋资源的开发与利用具有广阔的前景。海水的pH一般在7.5~8.6之间。某地海水中主要离子的含量如下表:
成分 | Na+ | K+ | Ca2+ | Mg2+ | Cl- | SO42- | HCO3- |
含量/mgL-1 | 9360 | 83 | 160 | 1100 | 16000 | 1200 | 118 |
(1)海水显弱碱性的原因是(用离子方程式表示):____________,该海水中Ca2+的物质的量浓度为__________mol/L 。
(2)电渗析法是近年发展起来的一种较好的海水淡化技术,其原理如下图所示。其中阴(阳)离子交换膜只允许阴(阳)离子通过,电极均为惰性电极。
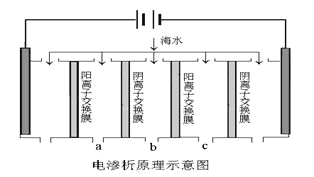
① 开始时阳极的电极反应式为________________。
② 电解一段时间,____极(填“阴”或“阳”)会产生水垢,其成份为_____(填化学式)。
③ 淡水的出口为a、b、c中的__________出口。
(3)海水中锂元素储量非常丰富,从海水中提取锂的研究极具潜力。锂是制造化学电源的重要原料,如LiFePO4电池某电极的工作原理如图所示:

该电池电解质为能传导 Li+的固体材料。
上面左图中的小黑点表示_____(填粒子符号),充电时该电极反应式为_______。
(4)利用海洋资源可获得MnO2 。MnO2可用来制备高锰酸钾:将MnO2与KOH混合后在空气中加热熔融,得到绿色的锰酸钾(K2MnO4),再利用氯气将锰酸钾氧化成高锰酸钾。该制备过程中消耗相同条件下氯气和空气的体积比为_________(空气中氧气的体积分数按20%计)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com