
分析 (1)据Cu+Fe2(SO4)3=CuSO4+2FeSO4,进行分析计算;
(2)据Fe3+的氧化性强于Cu2+,故Fe+Fe2(SO4)3=3FeSO4反应结束后,Fe+CuSO4=Cu+FeSO4据此进行分析计算.
解答 解:n总(CuSO4)=0.30mol•L-1×0.2L=0.06mol
Cu+Fe2(SO4)3=CuSO4+2FeSO4
64 1
6-2.8 n
$\frac{64}{6-2.8}=\frac{1}{n}$,则n=0.05mol,
n原(CuSO4)=n总(CuSO4)-n=0.06mol-0.05mol=0.01mol
C原(CuSO4)=$\frac{0.01mol}{0.2L}$=0.05mol•L-1
答:原混合溶液中CuSO4的物质的量浓度为0.05mol•L-1;
(2)①Fe不足Fe+Fe2(SO4)3=3FeSO4,则无固体生成,不符合题意,舍去;
②Fe过量,Fe+CuSO4=Cu+FeSO4 △m=8g
1 8
0.05mol•L-1×0.2L m
则:m=0.08g
m剩=6-56×0.05+0.08=3.28g
答:剩余固体的质量3.28g.
点评 本题考查氧化还原反应的计算,为高频考点,把握发生的反应及物质的量关系为解答的关键,侧重分析与计算能力的考查,题目难度不大.


 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案科目:高中化学 来源: 题型:实验题
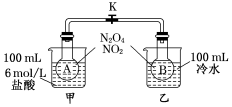 为测定温度对平衡的影响,设计了如下试验.
为测定温度对平衡的影响,设计了如下试验.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
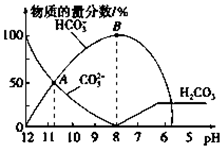 常温下,在10mL0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是( )
常温下,在10mL0.1mol•L-1Na2CO3溶液中逐滴加入0.1mol•L-1HCl溶液,溶液的pH逐渐降低,此时溶液中含碳微粒的物质的量分数变化如图所示(CO2因逸出未画出,忽略因气体逸出引起的溶液体积变化),下列说法正确的是( )| A. | 在A点所示的溶液中:c(CO32-)=c(HCO3-)>c(H+)>c(OH-) | |
| B. | 当溶液的pH为7时,溶液的总体积大于20mL | |
| C. | 在B点所示的溶液中,浓度最大的离子是HCO3- | |
| D. | 在0.1 mol•L-1 Na2CO3溶液中:c(Na+)+c(H+)=c(CO32-)+c(HCO3-)+c(OH-) |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
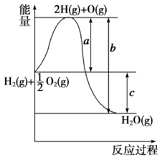 已知H2(g)+$\frac{1}{2}$O2(g)═H2O(g),反应过程中能量变化如图所示,则:
已知H2(g)+$\frac{1}{2}$O2(g)═H2O(g),反应过程中能量变化如图所示,则:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | $\frac{2b-c}{a}$ | B. | $\frac{2b-c}{2a}$ | C. | $\frac{2b-c}{3a}$ | D. | $\frac{2b-c}{6}$ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 上述反应中,每生成1mol SO42-,可脱去2mol Cl2 | |
| B. | 该反应中氧化剂是Cl2,反应消耗的氧化剂与还原剂之比为4:1 | |
| C. | 根据该反应可判断还原性:S2O32->Cl- | |
| D. | SO2也有漂白性,将SO2与氯气混合后使用,漂白性会增强 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结 论 |
| A | 测定等浓度的Na2CO3和Na2SO3溶液的pH | 前者pH比后者的大 | 非金属性:S>C |
| B | 溴乙烷与NaOH溶液共热后,加入AgNO3溶液 | 未出现淡黄色沉淀 | 溴乙烷没有水解 |
| C | 向等浓度的KCl、KI混合液中滴加AgNO3溶液 | 先出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
| D | 将KI和FeCl3溶液在试管中混合后,加入CCl4, 振荡,静置 | 下层液体显紫红色 | 氧化性:Fe3+>I2 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,33.6L HF中含有氟原子的数目为1.5NA | |
| B. | 常温下,2.7g金属铝与足量浓度为18.4mol/L的浓H2SO4反应时转移的电子数为0.3NA | |
| C. | Na2O与Na2O2的混合物共1mol,阴离子数目为NA | |
| D. | CH4与P4的分子结构都是正四面体,每1mol CH4分子与P4分子都含有4NA个共价键 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com